Comparamos o preço de Relvar Ellipta - 100Mcg + 25Mcg Com 30 Doses, veja o menor preço

R$ 169,73
RReferência
14
ofertasMelhores preços a partir de R$ 169,73 até R$ 211,05
Oferta patrocinada
vendido por Drogaria Nova Esperança
economize
19.58%
R$ 169,73
Mais de 47 anos de tradição, loja RA1000 e Ebit Diamante!
Oferta patrocinada
vendido por Drogarias Pacheco
economize
5.00%
R$ 200,50
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Farmácia.
Oferta patrocinada
vendido por Drogaria São Paulo
economize
5.00%
R$ 200,50
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Farmácia.
vendido por Farmácia Super Droga 10
economize
17.09%
R$ 174,99
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
vendido por Farma Prime
economize
16.63%
R$ 175,95
vendido por Pague Menos
economize
14.11%
R$ 181,28
vendido por Farmácia Preço Popular
economize
13.35%
R$ 182,88
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
vendido por Drogaria Soares
economize
10.00%
R$ 189,95
Enviamos para todo o Brasil. Clique e confira!
vendido por Agille Medicamentos
economize
8.88%
R$ 192,30
Preço Válido para compra em Boleto
vendido por Farmácia Indiana
economize
6.77%
R$ 196,76
vendido por Promofarma
economize
6.00%
R$ 198,39
vendido por Drogaria Catarinense
economize
1.87%
R$ 207,11
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Farmácia.
vendido por Farmácia Online Farmagora
economize
1.21%
R$ 208,50
Pagamento em até 6X sem juros. Frete Grátis! Regras no Site.
vendido por Panvel Farmácias
R$ 211,05
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
Para que serve
Relvar Ellipta é indicado para o tratamento regular da asma em adultos e adolescentes com 12 anos ou mais cujo uso do produto em combinação (corticosteroide inalatório e um agonista seletivo do receptor beta2 adrenérgico de ação prolongada) é apropriado:
Pacientes não adequadamente controlados com corticosteroide inalatório e quando necessário agonista seletivo do receptor beta2 adrenérgico de curta ação.
Relvar Ellipta é indicado para o tratamento sintomático de pacientes com doença pulmonar obstrutiva crônica (DPOC) com VEF1 <70% do normal previsto (pós-broncodilatador) e em pacientes com histórico de exacerbação.
Asma acontece quando os músculos ao redor das vias aéreas menores se tornam contraídos (broncoconstrição), inchados e irritados (inflamação). Os sintomas vêm e vão e incluem dificuldade de respirar, chiado, aperto no peito e tosse.
Doença pulmonar obstrutiva crônica (DPOC) acontece quando as vias aéreas se tornam inflamadas e espessas, geralmente devido tabagismo. É uma condição de longo prazo que piora lentamente. Os sintomas incluem dificuldade de respirar, tosse, desconforto no peito e tosse com muco. Foi demonstrado que Relvar Ellipta reduz a recidiva dos sintomas da DPOC.
Como o Relvar Ellipta funciona?
O furoato de fluticasona pertence a um grupo de medicamentos chamado corticosteroides, com frequência chamado simplesmente de esteroides. Os corticosteroides reduzem a inflamação. Eles reduzem o inchaço e irritação nas passagens de ar mais estreitas dos pulmões e assim melhoram problemas respiratórios. Os corticosteroides também ajudam a prevenir ataques de asma.
O furoato de fluticasona não deve ser confundido com outros esteroides, como os esteroides anabolizantes usados erroneamente por alguns atletas.
O vilanterol pertence a um grupo de medicamentos chamado broncodilatadores. Ele relaxa os músculos das passagens de ar nos pulmões. Isto ajuda a abrir as vias aéreas e facilita a entrada e saída de ar nos pulmões.
Quando usado regularmente, ajuda as vias aéreas a permanecerem abertas.
Quando você usar regularmente estes dois medicamentos, eles ajudarão a controlar suas dificuldades respiratórias.
Contraindicação
O uso de Relvar Ellipta é contraindicado para pacientes com alergia grave à proteína do leite e para os pacientes que tenham demonstrado hipersensibilidade ao furoato de fluticasona, ao trifenatato de vilanterol ou a qualquer componente da formulação.
Como usar
Relvar Ellipta é indicado apenas para inalação por via oral.
Relvar Ellipta deve ser administrado uma vez por dia, de manhã ou à noite, no mesmo horário todos os dias.
Relvar Ellipta deve ser utilizado regularmente, mesmo quando assintomático.
É muito importante que você use Relvar Ellipta todos os dias, como instruído pelo seu médico. Isto ajudará a mantê-lo livre dos sintomas ao longo do dia e da noite.
Relvar Ellipta não deve ser usado para alívio de ataque súbito de falta de ar ou chiado. Se você tiver este tipo de ataque você deve usar o medicamento de resgate prescrito pelo seu médico.
Se você sentir que está ficando sem ar ou com chiado mais frequentemente do que o normal, ou se você estiver usando o seu inalador de ação rápida mais que o usual, procure seu médico.
Posologia
Tratamento da Asma
Adulto e adolescentes com 12 anos de idade ou mais:
A dosagem recomendada é de uma inalação de Relvar Ellipta 100/25mcg uma vez ao dia no mesmo horário todos os dias.
Se você tem asma grave, o seu médico pode recomendar que você utilize uma inalação de Relvar Ellipta 200/25mcg uma vez por dia, no mesmo horário todos os dias.
Tratamento da DPOC
Adultos maiores de 18 anos:
A dosagem recomendada é de uma inalação de Relvar Ellipta 100/25mcg uma vez ao dia.
O Relvar Ellipta 200/25mcg não é indicado para pacientes com DPOC.
Modo de uso
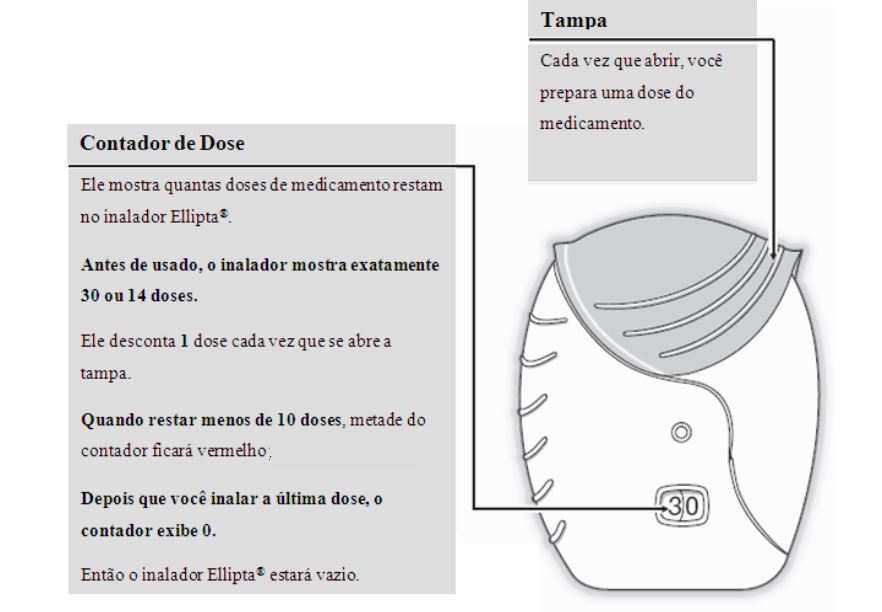
O inalador Ellipta é fornecido em uma bandeja com tampa laminada contendo dessecante, para reduzir a umidade. A bandeja protege contra a umidade e só deve ser aberta quando você estiver pronto para usá-lo pela primeira vez. Após aberto, descarte o dessecante. Não ingerir nem inalar esse material.
O inalador Ellipta está pronto para o uso, portanto quando utilizar pela primeira vez, você não precisa verificar se está funcionando corretamente ou prepará-lo de forma especial.
Só abra a tampa do inalador Ellipta quando estiver pronto para utilizar o produto.
Se abrir e fechar a tampa do inalador Ellipta sem inalar o medicamento, você perderá uma dose. A dose será mantida com segurança no inalador, porém não estará mais disponível para uso. O dispositivo Ellipta não permite que você inale uma quantidade maior do medicamento ou uma dose dupla acidentalmente.
O seu inalador Ellipta pode conter 30 ou 14 doses
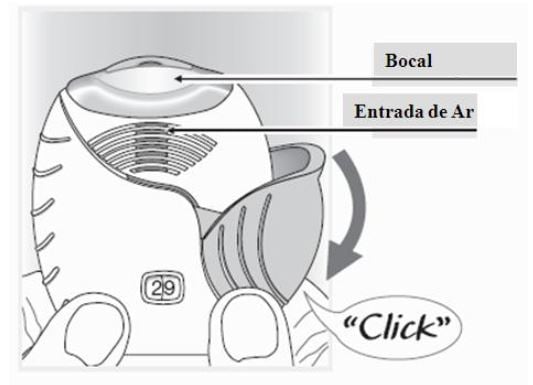
- Quando você retirar o inalador Ellipta da caixa, ele estará na posição fechada;
- Só abra a tampa do inalador Ellipta quando estiver pronto para tomar uma dose. Não agite o inalador Ellipta;
- Deslize a tampa para baixo até ouvir um “clique”;
- O medicamento está pronto para ser inalado e o contador de dose regride um número para confirmar;
- Se o contador de dose não realizar a contagem regressiva ao se ouvir o clique, o inalador Ellipta não liberará o medicamento;
- Sente-se ou fique de pé em posição confortável;
- Segurando o inalador longe da boca, expire confortavelmente o máximo que puder. Não expire sobre o inalador;
- Coloque o bocal entre seus lábios e feche-os firmemente ao redor dele;
- Não bloqueie a entrada de ar com os dedos;
- Faça uma inspiração longa, constante e profunda. Segure esta inspiração por pelo menos 3-4 segundos;
- Remova o inalador Ellipta da boca;
- Expire lenta e suavemente;

Mesmo quando usar o inalador Ellipta corretamente, poderá não sentir o gosto ou perceber o uso do medicamento.
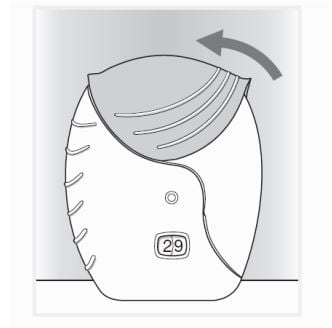
- Se quiser limpar o bocal, utilize um pano seco antes de fechar a tampa;
- Deslize a tampa para cima até fechar o bocal;
- Lave a boca com água sem engolir, depois de usar o inalador.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento.
Não interrompa o tratamento sem o conhecimento do seu médico.
O que devo fazer quando eu me esquecer de usar o Relvar Ellipta?
Não tome uma dose extra para compensar uma dose perdida. Apenas tome sua próxima dose no horário habitual.
Se você ficar sem ar ou com chiado, ou desenvolver qualquer outro sintoma de ataque de asma use o seu inalador de ação rápida ou procure ajuda médica.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Precauções
Não use Relvar Ellipta:
- Se você for alérgico a lactose ou à proteína do leite;
- Se você for alérgico ao furoato de fluticasona, ao trifenatato de vilanterol ou a qualquer outro ingrediente da formulação.
Se você pensa que qualquer uma destas condições se aplica a você, não use Relvar Elliptaaté que tenha verificado com seu médico.
Se você foi diagnosticado com intolerância a alguns açúcares, ou a proteína do leite, fale com seu médico antes de usar Relvar Ellipta.
Este medicamento contém lactose.
Converse com o seu médico antes de usar Relvar Ellipta:
- Se você tiver doença no fígado, pois você pode ter mais chance de apresentar efeitos colaterais;
- Se você tiver problemas cardíacos ou pressão arterial alta;
- Se você tiver tuberculose pulmonar ou infecções crônicas ou não tratadas;
- Se você tiver histórico de diabetes.
Reações alérgicas respiratórias imediatas procure assistência médica:
Se sua respiração ou chiado piorar logo após o uso de Relvar Ellipta, suspenda o uso imediatamente e informe seu médico o mais rápido possível.
Infecções nos pulmões:
Se você estiver utilizando Relvar Ellipta para tratamento da DPOC pode haver um maior risco de você desenvolver uma infecção dos pulmões conhecida como pneumonia. Informe o seu médico o mais rapidamente possível caso você apresente qualquer um dos sintomas.
Reações Adversas
Reações alérgicas:
São raras as reações alérgicas após o uso de Relvar Ellipta (ocorrem em menos de uma a cada mil pessoas). Se você apresentar algum dos sintomas abaixo, interrompa o uso deste medicamento e avise ao seu médico imediatamente
- Erupções na pele (urticária) ou vermelhidão;
- Inchaço, às vezes no rosto ou boca (angioedema);
- Tornar-se muito sibilante ou respirando com chiado, com tosse ou apresentar dificuldade para respirar;
- Sentir-se fraco repentinamente ou com sensação de desmaio (pode levar a um colapso ou perda de consciência).
Dificuldade Respiratórias imediatas:
Se sua respiração ou chiado ficarem piores logo após o uso de Relvar Ellipta, pare de usá-lo imediatamente, e avise a seu médico o mais rápido possível.
Infecção dos pulmões (pneumonia):
Avise seu médico se você tiver qualquer um dos seguintes sintomas enquanto usa Relvar Ellipta, pois estes podem ser sintomas de uma infecção pulmonar.
- Febre ou calafrios;
- Aumento na produção do escarro, alteração na cor do escarro;
- Aumento da tosse ou aumento da dificuldades em respirar.
Reações muito comuns (ocorre em mais de 10% dos pacientes que utilizam esse medicamento):
- Resfriado comum;
- Dor de cabeça.
Reações comuns (ocorre entre 1% e 10% dos pacientes que utilizam esse medicamento):
- Infecção dos pulmões (pneumonia);
- Placas doloridas na boca ou garganta causadas por infecção fúngica (candidíase). Enxaguar sua boca com água imediatamente após o uso de Relvar Ellipta pode ajudar a parar o desenvolvimento deste efeito colateral;
- Inflamação dos pulmões (bronquite);
- Infecção dos seios nasais ou garganta;
- Gripe (influenza);
- Dor e irritação na garganta;
- Inflamação dos seios da face (sinusite);
- Nariz entupido, escorrendo ou coçando;
- Tosse;
- Distúrbios da voz;
- Dor de estômago (dor abdominal);
- Dor nas costas;
- Enfraquecimento dos ossos, levando a fraturas;
- Temperatura alta (febre);
- Dor nas juntas;
- Espasmos musculares (contrações involuntárias do músculo).
Reações incomuns (ocorre entre 0,1% e 1% dos pacientes que utilizam esse medicamento):
- Batimento cardíaco irregular.
Reações raras (ocorrem entre 0,01% e 0,1% dos pacientes que utilizam este medicamento):
- Reações alérgicas (também descritas no tópico acima);
- Batimentos cardíacos acelerados (taquicardia);
- Percepção dos batimentos cardíacos (palpitações);
- Ansiedade;
- Tremor.
Atenção: este produto é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, informe seu médico.
População Especial
Crianças e adolescentes
Este medicamento não deve ser utilizado por crianças menores de 12 anos no tratamento da asma, ou para crianças e adolescentes de qualquer idade para o tratamento da DPOC.
Gravidez e lactação
Seu médico irá considerar o benefício para você e o risco para seu bebê ao usar Relvar Ellipta enquanto você estiver grávida.
Se você está grávida ou pensa que pode estar grávida, não use Relvar Ellipta sem perguntar ao seu médico.
Não se sabe se os ingredientes de Relvar Ellipta podem passar para o leite materno. Se você estiver amamentando, confirme com seu médico antes de usar Relvar Ellipta
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Efeitos sobre a Capacidade de Dirigir e Usar Máquinas
É improvável que este medicamento afete a sua capacidade de conduzir ou utilizar máquinas.
Composição
Cada dose contém
Relvar Ellipta 100mcg/25mcg:
| Furoato de fluticasona | 100mcg |
| Trifenatato de vilanterol (equivalente a 25mcg de vilanterol) | 40mcg |
| Excipiente: lactose monoidratada, estearato de magnésio q.s.p. | 1 dose |
Relvar Ellipta 200mcg/25mcg:
| Furoato de fluticasona | 200mcg |
| Trifenatato de vilanterol (equivalente a 25mcg de vilanterol) | 40mcg |
| Excipiente: lactose monoidratada, estearato de magnésio q.s.p. | 1 dose |
Superdosagem
Se você acidentalmente inalar uma dose maior de Relvar Ellipta do que aquela que seu médico lhe instruiu, informe o seu médico o mais rapidamente possível. Você pode notar que seu coração está batendo mais rapidamente que o habitual, que você está tremendo ou que tem dor de cabeça.
Se você tem usado doses maiores do que o indicado por um longo período de tempo, é particularmente importante que você peça orientação para seu médico. Isto porque grandes doses de Relvar Ellipta podem reduzir a quantidade de hormônios esteroides produzidos naturalmente por seu corpo.
Não há tratamento específico para overdose com o Relvar Ellipta. No caso de superdose, o paciente deve receber tratamento auxiliar com monitoração adequada, se necessário. Um tratamento adicional deve ser clinicamente indicado ou conforme recomendado pelo centro nacional de intoxicação, onde disponível.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Interação Medicamentosa
Interações medicamentosas clinicamente significativas, causadas por furoato de fluticasona ou trifenatato de vilanterol em doses clínicas, são consideradas improváveis devido às baixas concentrações plasmáticas atingidas após a inalação.
Interação com betabloqueadores
Os bloqueadores beta-adrenérgicos podem enfraquecer ou antagonizar o efeito dos agonistas beta2-adrenérgicos. O uso simultâneo de betabloqueadores não-seletivos e seletivos deve ser evitado, a menos que haja real necessidade para a sua utilização.
Interação com inibidores CYP3A4
O furoato de fluticasona e o trifenatato de vilanterol são rapidamente eliminados por metabolismo extenso de primeira passagem, obtido pela enzima hepática CYP3A4.
Deve-se tomar cuidado quando coadministrar com fortes inibidores CYP3A4 (por exemplo, cetoconazol, ritonavir), pois há a possibilidade de aumento da exposição sistêmica tanto ao furoato de fluticasona quanto ao vilanterol, e seu uso concomitante deve ser evitado. Um estudo de interação medicamentosa com repetição de dose CYP3A4 foi realizado em indivíduos saudáveis, com a combinação de furoato de fluticasona/vilanterol (200/25) e cetoconazol (400 mg), um forte inibidor da CYP3A4. A coadministração aumentou a ASC média (0-24) e Cmáx 36% e 33%, respectivamente. O aumento na exposição ao furoato de fluticasona foi associado a uma redução de 27% na concentração média ponderada de cortisol no soro de 0 - 24h. A coadministração aumentou a ASC(0-t) média e o Cmáx do trifenatato de vilanterol 65% e 22%, respectivamente.
O aumento da exposição ao trifenatato de vilanterol não foi associado com um aumento nos efeitos sistêmicos relacionados à beta-agonistas na frequência cardíaca, potássio no sangue ou intervalo QTcF.
Interação com inibidores da glicoproteína P
O furoato de fluticasona e o trifenatato de vilanterol são substratos da glicoproteína-P (P-gp). Um estudo de farmacologia clínica em indivíduos saudáveis com trifenatato de vilanterol coadministrado com forte P-gp e verapamil inibidor moderado da CYP3A4 não indicou qualquer efeito significativo sobre a farmacocinética do vilanterol. Estudos de farmacologia clínica com um inibidor específico da P-gp e furoato de fluticasona não foram realizados.
Medicamentos simpatomiméticos
A administração concomitante de outros medicamentos simpaticomiméticos (isoladamente ou como parte da terapia de associação) pode potencializar as reações adversas do furoato de fluticasona/vilanterol. O medicamento não deve ser usado em associação com outros beta2-adrenérgicos de longa ação.
População pediátrica
Estudos de interação foram realizados apenas em adultos.
Ação da Substância
Resultados de eficácia
Asma
Três estudos de fase III, randomizados, duplos-cegos (HZA106827, HZA106829 e HZA106837) de diferentes durações avaliaram a segurança e eficácia do medicamento em pacientes adultos e adolescentes com asma persistente.
Todos os indivíduos estavam usando um CI (corticoide inalatório) com ou sem beta2 agonista de longa duração (LABA) por pelo menos 12 semanas antes da visita 1. No HZA106837, todos os pacientes apresentaram pelo menos uma exacerbação que exigiu tratamento com corticosteroides orais no ano que antecedeu a visita 1. HZA106827 com 12 semanas de duração, avaliou a eficácia do medicamento 100/25 mcg [n=201] e FF (furoato de fluticasona) 100 mcg [n=205] comparado com placebo [n=203], todos administrados uma vez ao dia. HZA106829 com 24 semanas de duração, avaliou a eficácia do medicamento 200/25 mcg [n=197] e FF 200 mcg [n=194] ambos administrados uma vez ao dia comparado com propionato de fluticasona (PF) 500 mcg duas vezes ao dia [n=195].
No HZA106827/HZA106829 os objetivos primários de eficácia foram alteração do VEF1 do baseline na visita clínica (pré-boncodilatador e pós-dose) ao final do período de tratamento em todos os indivíduos e a média seriada de VEF1 ao longo de 24 horas, pós-dose calculada em um subgrupo de indivíduos no final do período do tratamento. O percentual de períodos de 24 horas livres de resgate durante o tratamento foi um parâmetro de avaliação secundário. Resultados dos objetivos primários e secundários nesses estudos estão descritos na Tabela 1.
Tabela 1 - Resultados dos objetivos de avaliação primários e principais secundários no HZA106827 e HZA106829:
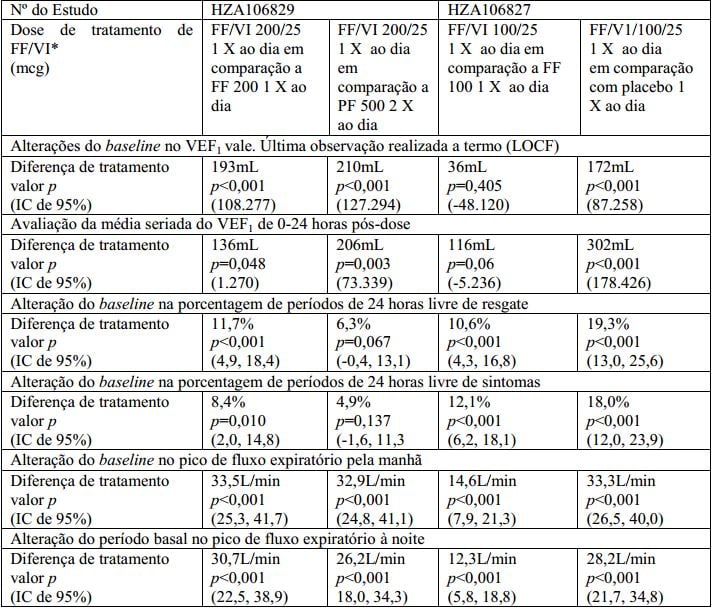
* FF/VI = furoato de fluticasona/vilanterol.
HZA106837 foi um estudo com tratamentos de duração variável (de um mínimo de 24 semanas para um máximo de 76 semanas com a maioria dos pacientes tratados por pelo menos 52 semanas). No HZA106837, os pacientes foram randomizados para receber o medicamento 100/25 mcg [n=1009] ou FF 100 mcg [n=1010] ambos administrados uma vez ao dia. O objetivo primário foi o tempo para a primeira exacerbação grave da asma. Uma exacerbação grave da asma é definida como a piora do quadro de asma exigindo o uso de corticosteroides sistêmicos por pelo menos 3 dias ou internação hospitalar ou visita à emergência. A alteração média do VEF1 vale em relação ao baseline, também foi avaliada como objetivo secundário.
No HZA106837, o risco de apresentar uma exacerbação grave da asma em pacientes recebendo Furoato de Fluticasona + Trifenatato de Vilanterol (substância ativa) 100/25 mcg foi reduzido em 20% comparado com a monoterapia de FF 100 mcg (razão de risco 0,795, p=0,036, IC de 95% (0,642, 0,985)).
A taxa de exacerbações graves da asma por paciente por ano foi 0,19 no grupo FF 100 mcg (aproximadamente 1 em cada 5 anos) e 0,14 no grupo Furoato de Fluticasona + Trifenatato de Vilanterol (substância ativa)100/25 mcg (aproximadamente 1 a cada 7 anos). A razão da taxa de exacerbação para Furoato de Fluticasona + Trifenatato de Vilanterol (substância ativa) 100/25 mcg em comparação com FF 100 mcg foi de 0,755 (IC de 95% 0,603, 0,945). Isto representa uma redução de 25% na taxa de exacerbação grave da asma para os indivíduos tratados com Furoato de Fluticasona + Trifenatato de Vilanterol (substância ativa) 100/25 mcg comparado com FF 100 mcg (p=0,014).
O efeito broncodilatador de 24 horas do medicamento foi mantido ao longo do período de um ano de tratamento sem evidência de perda de eficácia (sem taquifilaxia). Furoato de Fluticasona + Trifenatato de Vilanterol (substância ativa) 100/25 mcg demonstrou melhora consistente de 83 mL a 95 mL no VEF1 vale avaliado em 12, 36 e 52 semanas e no desfecho quando comparado com FF 100 mcg (p<0,001 IC de 95% 52, 126 mL). Quarenta e quatro porcento dos pacientes no grupo Furoato de Fluticasona + Trifenatato de Vilanterol (substância ativa)100/25 mcg foram bem controlados (ACQ7 ?0,75) no final do tratamento comparado com 36% dos indivíduos no grupo FF 100 mcg (p<0,001 IC de 95% 1,23, 1,82).
Estudos em comparação à combinação salmeterol/propionato de fluticasona
Em um estudo de 24 semanas (HZA1103091) em pacientes adultos e adolescentes com asma persistente, ambos os medicamentos 100/25 mcg administrado uma vez ao dia à noite e salmeterol/propionato de fluticasona (PF) 50/250 mcg administradas duas vezes ao dia demonstraram melhoras na função pulmonar em relação ao baseline. Aumentos na média de VEF1, em relação ao baseline, de 341 mL e 377 mL (salmeterol/PF) demonstraram uma melhora geral na função pulmonar ao longo de 24 horas para ambos os tratamentos. A diferença da média ajustada do tratamento de 37 mL entre os grupos não foi estatisticamente significativa (p=0,162). Para VEF1 indivíduos no grupo furoato fluticasona/vilanterol alcançou uma mudança média do baseline LS de 281 mL e para o grupo do salmeterol/PF uma mudança de 300 mL; (a diferença na média ajustada de 19 mL (IC 95%: - 0,073, 0,034) não foi estatisticamente significativa (p=0,485)).
Nenhum estudo comparativo versus salmeterol/PF ou outra combinação de ICS/LABA foi conduzido para comparar apropriadamente os efeitos nas exacerbações da asma.
Monoterapia com furoato de fluticasona
Um estudo de 24 semanas, randomizado, duplo-cego, controlado por placebo (FFA112059) avaliou a segurança e eficácia de FF 100 mcg uma vez ao dia [n=114] e PF 250 mcg duas vezes ao dia [n=114] em comparação com o placebo [n=115] em pacientes adultos e adolescentes com asma persistente. Todos os indivíduos estavam em doses estáveis de um CI por pelo menos 4 semanas antes da visita 1 (visita de avaliação inicial) e o uso de LABAs não foi permitido dentro das 4 semanas antecedentes à visita 1.
O objetivo primário foi avaliar a variação do VEF1 vale (pré-broncodilatador e de pré-dose), na visita clínica de baseline e no período final de tratamento. Alteração do baseline na porcentagem de períodos de 24 horas livre de resgate durante as 24 semanas de tratamento foi um objetivo secundário. Na 24a semana, FF e PF aumentaram o VEF1 vale em 146 mL (IC de 95% 36, 257 mL, p=0,009) e 145 mL (IC de 95% 33, 257 mL, p=0,011) respectivamente, comparado com placebo. Ambos FF e PF aumentaram a porcentagem dos períodos de 24 horas livre de resgate em 14,8% (IC de 95% 6,9, 22,7, p<0,001) e 17,9% (IC de 95% 10,0, 25,7, p<0,001) respectivamente em comparação com placebo.
Estudo de Provocação com Alérgenos
O efeito broncoprotetor de Furoato de Fluticasona + Trifenatato de Vilanterol (substância ativa) 100/25 mcg na resposta asmática precoce e tardia ao alérgeno inalado foi avaliado em um estudo cruzado, de quatro vias, de doses repetidas, controlado por placebo (HZA113126) em pacientes com asma leve.
Os pacientes foram randomizados para receber o medicamento 100/25 mcg, FF 100 mcg, VI (trifenatato de vilanterol) 25 mcg ou placebo uma vez ao dia por 21 dias, seguido por uma introdução do alérgeno 1 hora após a dose final. O alérgeno utilizado foi ácaro de pó domiciliar, pelo de gato, ou pólen de bétula; a seleção foi feita com base em testes de avaliação inicial individuais. Medidas de VEF1 seriadas foram comparadas com os valores pré-alérgeno realizadas após a inalação salina (baseline).
De modo geral, os maiores efeitos sobre a resposta asmática precoce foram observadas com o medicamento 100/25 mcg comparada com FF 100 mcg ou VI 25 mcg isolado. Ambos (100/25 mcg) e FF 100 mcg virtualmente aboliram a resposta asmática tardia comparado com VI isolado. O medicamento 100/25 mcg forneceu proteção significativamente maior contra hiperatividade brônquica induzida por alérgeno comparada com as monoterapias de FF e VI como avaliadas no dia 22 pela introdução de metacolina.
Doença Pulmonar Obstrutiva Crônica (DPOC)
O programa de desenvolvimento clínico de DPOC incluiu um estudo randomizado e controlado de 12 semanas (HCZ113107), dois estudos de 6 meses (HZV112206, HZC112207) e dois estudos de um ano (HZC102970, HZC102871) em pacientes com diagnóstico clínico de DPOC. Esses estudos incluíram medidas da função pulmonar, dispneia e exacerbações moderadas e graves.
Estudos de seis meses
HZC12206 e HZC112207 foram estudos de 24 semanas, randomizados, duplos-cegos, controlados por placebo, de grupos paralelos comparando o efeito de Furoato de Fluticasona + Trifenatato de Vilanterol (substância ativa) com VI e FF em monoterapias e placebo. HZC112206 avaliou a eficácia de Furoato de Fluticasona + Trifenatato de Vilanterol (substância ativa) 50/25 mcg [n=206] e Furoato de Fluticasona + Trifenatato de Vilanterol (substância ativa) 100/25 mcg [n=206] comparado com FF (100 mcg [n=206]), VI (25 mcg [n=205]) e placebo [n=207], todos administrados uma vez ao dia. HZC112207 avaliou a eficácia do medicamento 100/25 mcg [n=204] e 200/25 mcg [n=205] comparado com FF (100 mcg [n=204], 200 mcg [n=203]) e VI (25 mcg [n=203]) e placebo [n = 205], todos administrados uma vez ao dia.
Todos os pacientes que participaram possuíam um histórico de tabagismo de pelo menos 10 maços/ano; uma razão de VEF1/CVF pós-salbutamol de ? 0,70; VEF1 pós-salbutamol de ?70% previsto ou ter uma pontuação ?2 (escala 0-4) na escala de dispineia do Modified Medical Research Council (mMRC) na avaliação inicial. Na avaliação inicial, a média de VEF1 pós-broncodilatador foi de 42,6% e 43,6% previsto, e a média de reversibilidade foi 15,9% e 12,0% no HZC112206 e HZC112207, respectivamente. Os objetivos primários em ambos os estudos foram VEF1 média ponderada de 0 a 4 horas após a dose no dia 168 e alteração de VEF1 vale pré-dose no dia 169, em relação ao baseline.
Em uma análise integrada de ambos os estudos, o medicamento 100/25 mcg apresentou melhoras clinicamente significativas na função pulmonar. No dia 169, o medicamento 100/25 mcg e VI aumentaram VEF1 vale em 129 mL (IC de 95%: 91, 167 mL, p<0,001) e 83 mL (IC de 95%:46, 121 mL, p<0,001) respectivamente comparado com placebo. O medicamento 100/25 mcg aumentou VEF1 vale em 46 mL comparado com VI (IC de 95%:8, 83 mL, p=0,017). No dia 168, o medicamento100/25 mcg e VI aumentaram VEF1 média avaliada ao longo de 0-4 horas em 193 mL (IC de 95%: 156, 230 mL, p<0,001) e 145 mL (IC de 95%: 108, 181 mL, p<0,001) respectivamente comparada com placebo. O medicamento 100/25 mcg aumentou VEF1 médio ao longo de 0-4 horas em 48 mL comparado com FF monoterapia (IC de 95%: 112, 184 mL, p<0,001).
Estudos de 12 meses
HZC102970 e HZC102871 foram estudos de 52 semanas randomizados, duplos-cegos, de grupos paralelos comparando o efeito de o medicamento 200/25 mcg, o medicamento 100/25 mcg, o medicamento 50/25 mcg com VI 25 mcg, todos administrados uma vez ao dia, na taxa anual de exacerbações moderada/grave em indivíduos com DPOC com histórico de tabagismo de pelo menos 10 maços/anos e uma taxa de VEF1/CVF pós-salbutamol menor ou igual a 0,70 e VEF1 pós-salbutamol menor ou igual a 70% previsto e histórico documentado de ?1 exacerbação de DPOC que exigiu antibióticos e/ou corticosteroides orais ou hospitalização nos 12 meses antes da visita 1.
O objetivo primário foi a taxa anual de exacerbações moderada e grave. As exacerbações moderada/grave foram definidas como sintomas agravados que exigiram tratamento com corticosteroides orais e/ou antibióticos ou internação hospitalar. Ambos os estudos tiveram um período inicial aberto de 4 semanas durante o qual todos os indivíduos receberam salmeterol/PF 50/250 duas vezes ao dia para padronizar a farmacoterapia de DPOC e estabilizar a doença antes da randomização cega à medicação do estudo por 52 semanas. Antes do período inicial, os indivíduos descontinuaram as medicações de DPOC anteriores exceto broncodilatadores de curta ação.
O uso concomitante de broncodilatadores de longa ação (beta2 agonistas e anticolinérgicos), produtos de combinação de ipratrópio/salbutamol, beta2 agonistas orais, e preparados de teofilina não foram permitidos durante o período de tratamento. Corticosteroides orais e antibióticos foram permitidos para o tratamento agudo de exacerbações de DPOC com diretrizes de uso específicas. Indivíduos usaram salbutamol conforme necessário ao longo dos estudos.
Os resultados de ambos os estudos apresentaram que o tratamento com o medicamento 100/25 mcg uma vez ao dia resultou em uma taxa anual menor de exacerbações de DPOC moderada/grave quando comparada com VI e encontram-se na Tabela 2).
Tabela 2 Análise das Taxas de Exacerbação após 12 meses de tratamento:
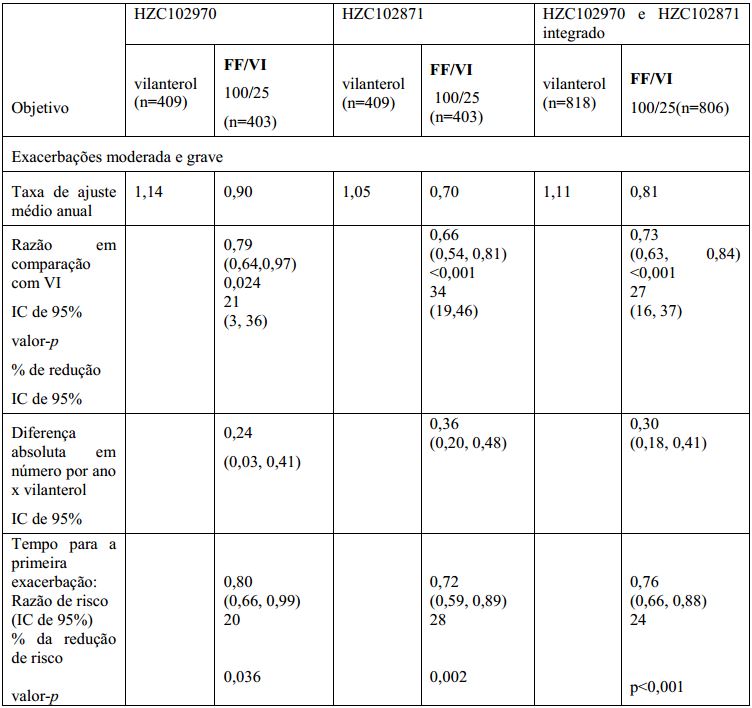
Em uma análise integrada de HZC102970 e HZC102871 na semana 52, foi observada uma melhora quando comparado o medicamento 100/25 mcg com VI 25 mcg na média ajustada de VEF1 vale (42 mL IC de 95%: 0,019, 0,064, p<0,001). O efeito do broncodilatador de 24 horas de medicamento foi mantido ao longo do período de um ano de tratamento sem evidência de perda na eficácia (ausência de taquifilaxia).
De modo geral, entre os dois estudos combinados, 2009 (62%) pacientes possuíam histórico de fatores de risco cardiovascular na avaliação inicial. A incidência de fatores de risco cardiovasculares foi semelhante entre os grupos de tratamento com pacientes mais comumente sofrendo de hipertensão (46%), seguido por hipercolesterolemia (29%) e diabetes mellitus (12%).
Efeitos semelhantes na redução de exacerbações moderada e grave foram observados nesse subgrupo quando comparado com a população geral. Em pacientes com histórico/fatores de risco cardiovasculares, Fluticasona + Trifenatato de Vilanterol (substância ativa) 100/25 mcg resultou em uma redução significativa na taxa anual de exacerbações de DPOC moderada/grave comparada com VI (média ajustada das taxas anual de 0,83 e 1,18 respectivamente, 30% de redução (IC de 95% 16,42%, p<0,001). Melhoras também foram vistas neste subgrupo na semana 52 quando comparou Fluticasona + Trifenatato de Vilanterol (substância ativa)100/25 mcg com VI 25 mcg na média ajustada de VEF1 vale (44 mL IC de 95%: 15,73 mL, p=0,003).
Estudos em comparação à combinação salmeterol/propionato de fluticasona
Em um estudo de 12 semanas (HZC113107) em pacientes com DPOC, ambos Fluticasona + Trifenatato de Vilanterol (substância ativa) 100/25 mcg administrado uma vez ao dia pela manhã e salmeterol/PF 50/500 mcg administrado duas vezes ao dia, demonstraram melhoras na função pulmonar em relação ao baseline. Acréscimos à partir do baseline VEF médio 0-24 horas de 130 mL (Fluticasona + Trifenatato de Vilanterol (substância ativa) ) e 108 mL (PF/salmeterol) demonstraram uma melhora geral na função pulmonar ao longo de 24 horas para ambos os tratamentos.
A diferença da média ajustada no tratamento de 22 mL (IC de 95%: -18, 63 mL) entre os grupos não foi estatisticamente significativa (p=0,282). A variação média ajustada do baseline no VEF1 no dia 85 foi de 111 mL no grupo furoato de fluticasona/vilanterol e 88 mL no grupo salmeterol/PF, os 23 mL (IC 95%: -20, 66) de diferença entre os grupos de tratamento não foi clinicamente e nem estatisticamente significativa (p=0,294). Nenhum estudo comparativo versus salmeterol/PF ou outros broncodilatadores estabelecidos foi conduzido para comparar apropriadamente os efeitos nas exacerbações da DPOC.
Características farmacológicas
Propriedades farmacodinâmicas
Mecanismo de ação
O furoato de fluticasona e o trifenatato de vilanterol representam duas classes de medicamentos (um corticosteroide sintético e um agonista seletivo do receptor beta2, de ação prolongada).
Efeitos farmacodinâmicos
Furoato de fluticasona
O furoato de fluticasona é um corticosteroide sintético trifluorado com potente atividade anti-inflamatória. Não é conhecido o mecanismo preciso pelo qual o furoato de fluticasona age sobre os sintomas de asma e DPOC. Os corticosteroides comprovadamente têm um grande número de ações em vários tipos de células (por exemplo, eosinófilos, macrófagos, linfócitos) e mediadores (por exemplo, citocinas e quimiocinas envolvidas na inflamação).
Trifenatato de vilanterol
O trifenatato de vilanterol é um agonista seletivo beta2 adrenérgico de ação prolongada (LABA).
Os efeitos farmacológicos das drogas agonistas beta2-adrenérgicas, incluindo trifenatato de vilanterol, são pelo menos em parte atribuíveis à estimulação da adenilato ciclase intracelular, a enzima que catalisa a conversão da adenosina trifosfato (ATP) para adenosina monofosfato cíclica-3’, 5’ (AMP cíclica). Níveis aumentados de AMP cíclica causam relaxamento da musculatura lisa brônquica e inibição da liberação de mediadores da hipersensibilidade imediata das células, especialmente de mastócitos.
Interações moleculares ocorrem entre corticoides e LABAs, onde os esteroides ativam o gene do receptor beta2, aumentando a sensibilidade do número de receptores; e os LABAs preparam o receptor de glicocorticoides para ativação dependente de esteroide e melhoria da translocação nuclear celular.
Esta interações sinérgicas são refletidas na maior atividade anti-inflamatória, que foi demonstrada in vitro e in vivo em uma série de células inflamatórias relevantes para a fisiopatologia da asma e DPOC. Estudos de biópsia das vias aéreas também têm demonstrado que a sinergia entre corticoides e LABAs ocorre em doses clínicas dos medicamentos em pacientes com DPOC.
Propriedades farmacocinéticas
Absorção
As biodisponibilidades absolutas do furoato de fluticasona e do trifenatato de vilanterol, quando administrados por inalação como Fluticasona + Trifenatato de Vilanterol (substância ativa), foram em média de 15,2% e 27,3%, respectivamente. As biodisponibilidades orais do furoato de fluticasona e do trifenatato de vilanterol foram baixas, em média de 1,26% e < 2%, respectivamente. Dada esta baixa biodisponibilidade oral, a exposição sistêmica ao furoato de fluticasona e ao trifenatato de vilanterol após inalação é principalmente devida à absorção de parte da dose inalada entregue ao pulmão.
Distribuição
Após administração intravenosa, tanto o furoato de fluticasona quanto o trifenatato de vilanterol são amplamente distribuídos com volumes médios de distribuição no estado estacionário de 661 L e 165 L, respectivamente.
Tanto o furoato de fluticasona quanto o trifenatato de vilanterol têm pequena associação com os glóbulos vermelhos. A ligação às proteínas plasmáticas in vitro no plasma humano do furoato de fluticasona e do trifenatato de vilanterol foi elevada, em média > 99,6% e 93,9%, respectivamente. Não houve nenhuma diminuição no grau de ligação às proteínas plasmáticas in vitro nos indivíduos com comprometimento renal ou hepático.
O furoato de fluticasona e o trifenatato de vilanterol são substratos para a glicoproteína-P (P-gp); entretanto, a administração concomitante de furoato de fluticasona/trifenatato de vilanterol com inibidores da P-gp é considerada com pouca probabilidade de alterar a exposição sistêmica ao furoato de fluticasona ou ao trifenatato de vilanterol, uma vez que eles têm moléculas bem absorvidas.
Metabolismo
Com base em dados in vitro, as principais rotas do metabolismo tanto do furoato de fluticasona quanto do trifenatato de vilanterol em humanos são obtidas principalmente pela CYP3A4.
O furoato de fluticasona é metabolizado principalmente por hidrólise do grupo de metabólitos S-fluorometil carbotioato com atividade corticosteroide significativamente reduzida. O trifenatato de vilanterol é metabolizado principalmente por O-dealquilação para uma faixa de metabólitos com atividade agonista ß1 e ß2 significativamente reduzida.
Eliminação
Após administração oral, o furoato de fluticasona foi eliminado nos seres humanos principalmente pelo metabolismo, com metabólitos sendo excretados quase exclusivamente nas fezes, com < 1% da dose radioativa recuperada sendo eliminada na urina.
Após administração oral, o trifenatato de vilanterol foi eliminado nos seres humanos principalmente pelo metabolismo, seguido de excreção de metabólitos na urina e fezes de aproximadamente 70% e 30% da dose radioativa respectivamente.
A meia vida de eliminação no plasma do trifenatato de vilanterol após inalação da combinação furoato de fluticasona/trifenatato de vilanterol foi em média de 2,5 horas. A meia-vida eficaz para a acumulação de vilanterol, conforme administração por inalação de doses repetidas de vilanterol 25 mcg é de 16 horas em indivíduos com asma e 21,3 horas em indivíduos com DPOC.
Crianças
Em adolescentes (12 anos ou mais), não há nenhuma modificação de dose recomendada.
Não foi estudada a farmacocinética do furoato de fluticasona/trifenatato de vilanterol em pacientes com menos de 12 anos de idade. A segurança e a eficácia do furoato de fluticasona/trifenatato de vilanterol em crianças com menos de 12 anos ainda não foram estabelecidas
Idosos (a partir de 65 anos)
Os efeitos da idade sobre a farmacocinética do furoato de fluticasona e trifenatato de vilanterol foram determinados em estudos de fase III em DPOC e asma. Não houve nenhuma evidência de que a idade (12 a 84 anos) afete a farmacocinética do furoato de fluticasona e trifenatato de vilanterol em indivíduos com asma. Não houve nenhuma evidência de que a idade afete a farmacocinética do furoato de fluticasona em indivíduos com DPOC, sendo que houve um aumento (37%) na ASC(0-24) do trifenatato de vilanterol na faixa de idade observada de 41 a 84 anos.
Para um indivíduo idoso (84 anos) com baixo peso corporal (35 kg), a ASC(0-24) do trifenatato de vilanterol é prevista ser 35% maior do que a estimativa da população (indivíduo com DPOC com idade de 60 anos e peso corporal de 70 kg), enquanto o Cmáx ficou inalterado. Estas diferenças não devem apresentar relevância clínica.
Em indivíduos com asma e indivíduos com DPOC não houve modificações recomendadas das dose.
Comprometimento renal
Um estudo de farmacologia clínica do furoato de fluticasona/trifenatato de vilanterol mostrou que uma disfunção renal grave (eliminação da creatinina < 30 mL/min) não resultou em exposição significativamente maior ao furoato de fluticasona ou ao trifenatato de vilanterol, ou efeitos sistêmicos mais marcados de corticoides ou de beta2-agonistas em comparação com indivíduos saudáveis.
Nenhum ajuste de dosagem é necessário para pacientes com comprometimento renal. Os efeitos da hemodiálise não foram estudados.
Comprometimento Hepático
Após administração continuada do furoato de fluticasona/ trifenatato de vilanterol por 7 dias, houve um aumento na exposição sistêmica do furoato de fluticasona (até três vezes, medida pela ASC(0–24)) em indivíduos com insuficiência hepática (Child-Pugh A, B ou C) em comparação com indivíduos saudáveis. O aumento da exposição sistêmica do FF (furoato de fluticasona / trifenatato de vilanterol 200/25 mcg) em indivíduos com insuficiência hepática moderada (Child-Pugh B) foi associado com uma redução média de 34% no cortisol sérico em comparação com indivíduos saudáveis. A exposição sistêmica do furoato de fluticasona com dose normalizada foi semelhante em indivíduos com insuficiência hepática moderada e grave (Child-Pugh B ou C).
Após administração contínua de furoato de fluticasona/ trifenatato de vilanterol por 7 dias, não houve nenhum aumento significativo na exposição sistêmica ao trifenatato de vilanterol (Cmáx e ASC) em indivíduos com insuficiência hepática leve, moderada ou grave (Child-Pugh A, B ou C).
Não houve efeitos clinicamente relevantes da combinação furoato de fluticasona/ vilanterol nos efeitos sistêmicos beta-adrenérgicos (frequência cardíaca ou potássio sérico) em indivíduos com insuficiência hepática leve ou moderada (trifenatato de vilanterol, 25 mcg) ou com insuficiência hepática grave (trifenatato de vilanterol, 12,5 mcg) em comparação com indivíduos saudáveis.
Outras populações
Em indivíduos com asma ou DPOC, as estimativas de ASC(0-24) de furoato de fluticasona para indivíduos do Leste Asiático, Japão e Sudeste Asiático (12-13% de indivíduos) foram em média de 33% a 53% superiores em comparação com outros grupos raciais. No entanto, não havia nenhuma evidência para a maior exposição sistêmica nessas populações a ser associada com maior efeito sobre a excreção de cortisol urinário de 24 horas.
Em média, o Cmáx do trifenatato de vilanterol é estimado entre 220 e 287% superior e a ASC(0-24) comparáveis para os indivíduos de herança asiática em comparação com indivíduos de outros grupos raciais. No entanto, não houve nenhuma evidência de que este Cmáx superior do trifenatato de vilanterol tenha resultado em efeitos clinicamente significativos na frequência cardíaca.
Em indivíduos com DPOC ASC(0-24) estimada de fluticasona para indivíduos do Oeste asiático, Japoneses e Sudoeste asiático (12-13% dos indivíduos) houve uma média de 23% a 30% maior comparada com indivíduos caucasianos. No entanto, não houve evidência de uma maior exposição sistêmica nesta população estando associada com um maior efeito em 24 horas na excreção urinária de cortisol. Não houve efeito de raça sobre as estimativas de parâmetros farmacocinéticos do trifenatato de vilanterol em indivíduos com DPOC.
Sexo, peso e IMC
Não houve nenhuma evidência quanto a sexo, peso ou IMC para influenciar a farmacocinética do furoato de fluticasona com base em uma análise farmacocinética populacional de dados de fase III em 1.213 indivíduos com asma (712 mulheres) e 1.225 indivíduos com DPOC (392 mulheres).
Não houve nenhuma evidência quanto a sexo, peso ou IMC para influenciar a farmacocinética do trifenatato de vilanterol com base em uma análise farmacocinética populacional em 856 indivíduos com asma (500 mulheres) e 1.091 indivíduos com DPOC (340 mulheres).
Nenhum ajuste de dose é necessário com base em sexo, peso ou índice de massa corporal (IMC).
Dados de segurança pré-clínica
Efeitos farmacológicos e toxicológicos observados com furoato de fluticasona ou vilanterol em estudos não clínicos foram aqueles tipicamente associados com glicocorticoides ou beta2 agonistas. A administração de furoato de fluticasona combinada com vilanterol não resultou em nenhuma nova toxicidade significativa.
Carcinogênese/mutagênese
O furoato de fluticasona não foi genotóxico em uma bateria de estudos padrões e não foi carcinogênica em estudos de inalação vitalício de ratos ou camundongos em exposições semelhantes àquelas doses máximas recomendadas em humanos, baseado em ASC.
Estudos de toxicidade genética indicam que vilanterol não representa um perigo genotóxico para humanos.
Consistente com achados para outros beta2-agonistas, estudos de inalação vitalício com vilanterol causaram efeitos proliferativos no trato reprodutivo de fêmeas de rato e camundongo e na glândula pituitária de ratos.
Não houve um aumento na incidência tumoral em ratos ou camundongos em exposições de 2 a 30 vezes, respectivamente, àquelas doses máximas recomendadas em humanos, baseado em ASC.
Toxicologia Reprodutiva
Efeitos observados após a administração por inalação de furoato de fluticasona em combinação com vilanterol em ratos foi semelhante àquelas observadas com furoato de fluticasona isolado.
O furoato de fluticasona não foi teratogênico em ratos ou coelhos, mas atrasou o desenvolvimento de ratos e causou aborto em coelhos em doses maternalmente tóxicas. Não houve efeitos no desenvolvimento de ratos em exposições aproximadamente 3 vezes maiores do que as doses máximas recomendadas em humanos, baseado em ASC.
O vilanterol não foi teratogênico em ratos. Em estudos de inalação em ratos, vilanterol causou efeitos semelhantes aos vistos com outros beta2-agonistas (fenda palatina, pálpebras abertas, fusão do esterno e mal rotação/flexão dos membros). Quando administrado via subcutânea, não existem efeitos na exposição 84 vezes maiores do que aqueles da dose máxima recomendada em humanos, baseado em AUC.
Nem furoato de fluticasosa ou vilanterol não apresentaram efeitos adversos na fertilidade ou desenvolvimento em ratos pré e pós-natal.
Cuidados de Armazenamento
O produto deve ser mantido em sua embalagem original, em temperatura ambiente (entre 15ºC e 30ºC).
Após aberto, válido por 1 mês.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Aspectos físicos / Características organolépticas
O inalador plástico Ellipta consiste de um dispositivo cinza claro, com tampa azul e contador de dose embalados em uma bandeja contendo dessecante. A bandeja é vedada com uma tampa laminada destacável.
O inalador contém duas tiras de strip com 14 ou 30 doses regularmente distribuídas, cada uma contendo pó branco.
Todo medicamento deve ser mantido fora do alcance das crianças.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Dizeres Legais
MS: 1.0107.0299
Farm. Resp.:
Edinilson da Silva Oliveira
CRF-RJ Nº 18875
Fabricado por:
Glaxo Operations UK Limited.
Priory Street, Ware, Hertfordshire, SG12 0DJ – Inglaterra
Registrado e Importado por:
GlaxoSmithKline Brasil Ltda.
Estrada dos Bandeirantes, 8464 - Rio de Janeiro - RJ
CNPJ: 33.247.743/0001-10
Venda sob prescrição médica.