Comparamos o preço de Symbicort - Turbo 12/400Mcg 60Doses, veja o menor preço

R$ 142,14
RReferência
12
ofertasMelhores preços a partir de R$ 138,54 até R$ 218,68
Oferta patrocinada
vendido por Drogaria São Paulo
economize
35.00%
R$ 142,14
Oferta patrocinada
vendido por Drogarias Pacheco
economize
31.67%
R$ 149,43
vendido por Drogaria Araújo
economize
36.65%
R$ 138,54
vendido por Drogaria Primus
economize
35.34%
R$ 141,39
vendido por Farmácia Preço Popular
economize
19.55%
R$ 175,93
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Drogaria.
vendido por Pague Menos
economize
16.78%
R$ 181,99
vendido por Drogaria Soares
economize
12.28%
R$ 191,82
Enviamos para todo o Brasil. Clique e confira!
vendido por Farmácia Indiana
economize
10.01%
R$ 196,80
vendido por Promofarma
economize
6.00%
R$ 205,55
vendido por Farmácia Online Farmagora
economize
3.71%
R$ 210,57
Pagamento em até 6X sem juros. Frete Grátis! Regras no Site.
vendido por Drogaria Catarinense
economize
3.71%
R$ 210,57
Dúvidas quanto ao Preço ou Frete? Clique e vá direto ao site da Farmácia.
vendido por Sansil Farma
R$ 218,68
Frete Reduzido para o estado de São Paulo acesse e confira
Para que serve
Asma
Em adultos e crianças (a partir de 4 anos de idade) Symbicort Turbuhaler está indicado no tratamento da asma nos casos em que o uso de uma associação (corticosteroide inalatório com um beta-2 agonista de ação prolongada) é apropriado.
Doença pulmonar crônica (DPOC)
Em adultos Symbicort Turbuhaler está indicado no tratamento regular de pacientes com doença pulmonar obstrutiva crônica (DPOC) moderada a grave, com sintomas frequentes e história de exacerbações.
Como o Symbicort Turbuhaler funciona?
Symbicort Turbuhaler é uma mistura de budesonida e formoterol que possui diferentes maneiras de tratar doenças respiratórias (asma e doença pulmonar obstrutiva crônica). Essas doenças são causadas pela inflamação das vias aéreas. A budesonida reduz e previne a inflamação, enquanto que o formoterol amplia as vias respiratórias e torna mais fácil a respiração.
O uso de Symbicort Turbuhaler melhora e controla a falta de ar em pacientes asmáticos e em portadores de doença pulmonar obstrutiva crônica.
Este efeito começa dentro de 1-3 minutos após a inalação do medicamento e dura até 12 horas. Quando você inala pelo bocal, a medicação segue para seus pulmões.
Contraindicação
Symbicort Turbuhaler não deve ser usado por pessoas alérgicas à budesonida, ao fumarato de formoterol di-hidratado ou à lactose inalatória.
Como usar
Instruções para uso - Leia antes de usar
Conheça o produto:
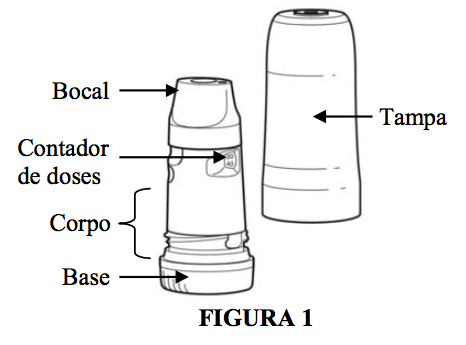
O medicamento que você vai utilizar é um pó e não um jato. Como este pó está em pequena quantidade, é provável que você não sinta o gosto ou o cheiro do produto durante a utilização.
O contador de doses do Turbuhaler (inalador) não é unitário (60, 59, 58, 57...), e, portanto, você somente verá números no visor a cada 20 doses utilizadas (começando com o número 60 seguido de 40, 20 e 0).
Instruções de uso:
Preparo do Turbuhaler (inalador) e inalação:
|
|
| |
| |
| |
| |
| |
| |
| |
|
Você poderá não sentir o gosto do produto, mas a dose terá sido recebida mesmo assim. Caso tenha sido prescrita mais de uma inalação, repita os passos 2 a 9.
Lembre-se que a numeração do contador não mudará a cada dose. Troque por um frasco novo quando o contador chegar ao zero e a parte vermelha preencher o visor do contador.
Nunca empreste seu Turbuhaler para outra pessoa.
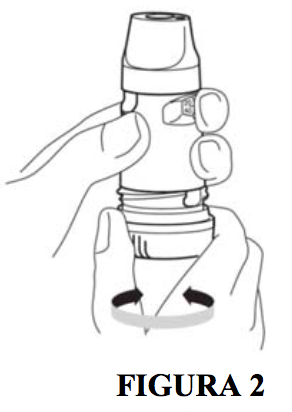
Somente na primeira vez do uso, ao abrir uma nova caixa do produto (e após remover o lacre e girar (desrosquear) para retirar a tampa externa do produto), verifique o contador de doses, o mesmo deve mostrar o número 60. Com o produto na posição vertical, girar a base vermelha 3 vezes seguidas para cada lado (após cada movimentação você escutará um clique e, portanto, ao finalizar as três movimentações você escutará três cliques) (figura 2). Após isso, aspirar seguindo o preparo acima (passos 4 a 9).
Em todas as outras vezes que for utilizar o produto, gire a base vermelha apenas uma vez para cada lado antes de cada dose (figura 2) e aspire seguindo o preparo acima (passos 4 a 9).
Limpeza
Uma vez por semana, deve-se limpar a parte externa do bocal com um pano seco. Nunca lave o inalador, pois o seu conteúdo é sensível à umidade.
Perguntas mais frequentes
Por que giro a base?
Porque, ao girá-la, a dose será carregada.
Por que na primeira vez que uso, carrego a dose 3 vezes?
Para uniformizar a primeira dose.
Se eu giro três vezes a base na primeira vez, eu uso 3 doses?
Não, o compartimento que libera a dose no Turbuhaler só carrega uma dose.
Aspirei a primeira dose e o contador não sai do 60, está quebrado?
Não, você só verá números no visor do contador de doses a cada 20 doses utilizadas (60, 40, 20, 0).
Por que não sinto nada quando aspiro?
A quantidade de medicamento liberada em cada inalação é muito pequena. Assim, é provável que você não sinta gosto ou cheiro algum durante a inalação.
Usei todas as doses, o contador de doses mostra o número 0 e mesmo assim quando agito o Turbuhaler escuto um barulho. Ainda tem produto?
O som que você escuta ao agitar o inalador não é medicamento; é do agente dessecante que está no interior do inalador, usado para proteger o produto da umidade.
O que acontece quando eu giro a base várias vezes e não aspiro?
O contador diminuirá de acordo com a quantidade de vezes que a base for girada, ou seja, as doses serão contadas, embora não tenham sido aspiradas. Se você voltar a aspirar pelo inalador, apenas uma dose será inalada. Mesmo girando a base várias vezes, apenas uma dose é inalada por vez, pois não tem acúmulo de doses.
O que acontece se eu girar a base para um lado e para o outro várias vezes e aspirar uma única vez?
Uma única dose será inalada. Exceto se a cada vez que a dose for carregada você também aspirar pelo inalador.
Por que devo enxaguar a boca após usar o produto?
Para que possíveis resíduos do medicamento sejam removidos da boca.
É normal o bocal girar para os dois lados, sem travar?
Sim, o bocal gira para se adaptar à sua boca na hora de inalar o produto. Não tente removê-lo, pois ele é fixo.
Vai sair um jato?
Diferente das “bombinhas” de inalação, que liberam um “spray”, o Symbicort é um pó inalante, portanto, quando você carregar a dose não saíra um jato. Você terá que inalar o pó (aspirar pelo aparelho) para levá-lo até o pulmão.
Como sei que o produto está acabando?
Se utilizado conforme as instruções de uso, quando um fundo vermelho com o número zero (0) inscrito sobre ele preencher o visor do contador de doses, o produto não terá mais medicamento, devendo ser descartado. Note que, mesmo o contador registrando zero (0), é possível girar a base vermelha. Entretanto, o indicador para de se mover e o zero (0) permanece no visor.
A dose de Symbicort Turbuhaler deve ser individualizada conforme a gravidade da doença.
Quando for obtido o controle da asma, a dose deve ser titulada para a menor dose que permita manter um controle eficaz dos sintomas.
Asma
Há duas alternativas para o tratamento da asma com Symbicort Turbuhaler.
Terapia com um único inalador
Os pacientes utilizam o Symbicort Turbuhaler para uma dose de manutenção diária e administram inalações adicionais, conforme a necessidade, para alívio rápido dos sintomas e melhora do controle da asma. Os pacientes devem ser aconselhados a ter Symbicort Turbuhaler sempre à disposição. Não é necessário ter um inalador separado para o alívio dos sintomas.
Os pacientes devem ser aconselhados a ter Symbicort Turbuhaler sempre à disposição. Não é necessário ter um inalador separado para o alívio dos sintomas.
Terapia de Manutenção Regular
Os pacientes utilizam o Symbicort Turbuhaler para uma dose de manutenção diária e administram separadamente um broncodilatador de ação rápida para alívio dos sintomas. Os pacientes devem ser aconselhados a ter este broncodilatador de ação rápida sempre à disposição.
Posologia
Symbicort Turbuhaler 6/100 mcg/inalação
Adultos e adolescentes (a partir de 12 anos de idade)
A dose de manutenção diária recomendada é de 2 inalações, uma administrada de dia e uma à noite ou as duas inalações em um dos períodos. Os pacientes devem administrar uma inalação adicional, conforme sua necessidade, em resposta aos sintomas. Caso os sintomas persistam após alguns minutos, outra inalação deve ser administrada. Não devem ser administradas mais que 6 inalações, em uma mesma ocasião, para controle dos sintomas.
Crianças (a partir de 4 anos de idade)
A dose diária recomendada é de 1 inalação. Os pacientes podem administrar uma inalação adicional, conforme sua necessidade, em resposta aos sintomas. Caso os sintomas persistam após alguns minutos, outra inalação deve ser administrada. Não devem ser utilizadas mais que 4 inalações, em uma mesma ocasião, para controle dos sintomas.
Limite Máximo Diário
Doses diárias totais maiores que 8 inalações para adultos e adolescentes e 4 inalações para crianças não são normalmente necessárias. Entretanto, doses diárias totais de até 12 inalações para adultos e adolescentes e 8 inalações para crianças podem ser utilizadas temporariamente. Se o paciente apresentar piora após as administrações da terapia de manutenção adequada e de doses adicionais para alívio dos sintomas, a terapia da asma deve ser reavaliada.
Symbicort Turbuhaler 6/200 mcg/inalação
Adultos e adolescentes (a partir de 12 anos de idade)
A dose de manutenção diária recomendada é de 2 inalações, uma administrada de dia e uma à noite ou as duas inalações em um dos períodos. Os pacientes devem administrar uma inalação adicional, conforme sua necessidade, em resposta aos sintomas. Caso os sintomas persistam após alguns minutos, outra inalação deve ser administrada. Não devem ser administradas mais que 6 inalações, em uma mesma ocasião, para controle dos sintomas.
Limite Máximo Diário
Doses diárias totais maiores que 8 inalações não são normalmente necessárias. Entretanto, doses diárias totais de até 12 inalações podem ser utilizadas temporariamente. Se o paciente apresentar piora após as administrações da terapia de manutenção adequada e de doses adicionais para alívio dos sintomas, a terapia da asma deve ser reavaliada.
Terapia de manutenção regular
Symbicort Turbuhaler é utilizado na manutenção regular do tratamento, com um broncodilatador de ação rápida separado para emergência. Os pacientes devem ser aconselhados a ter seu broncodilatador de ação rápida separado e disponível para uso em casos de emergência.
Symbicort Turbuhaler 6/100 mcg/inalação
Adultos (a partir de 18 anos de idade)
1-2 inalações uma ou duas vezes ao dia.
Em alguns casos, pode ser necessário um máximo de 4 inalações, duas vezes ao dia, como dose de manutenção ou temporariamente durante a piora da asma.
Adolescentes (12-17 anos de idade)
1-2 inalações uma ou duas vezes ao dia.
Durante a piora da asma, a dose pode ser temporariamente aumentada para um máximo de 4 inalações, duas vezes ao dia.
Crianças (a partir de 4 anos de idade)
1-2 inalações duas vezes ao dia. Dose máxima diária de 4 inalações.
O aumento do uso de broncodilatadores de resgate é indicativo de agravamento da condição subjacente, justificando a reavaliação da terapia.
Symbicort Turbuhaler 6/200 mcg/inalação
Adultos (a partir de 18 anos de idade)
1-2 inalações uma ou duas vezes ao dia. Em alguns casos, pode ser necessário um máximo de 4 inalações, duas vezes ao dia, como dose de manutenção ou temporariamente durante uma piora da asma.
Adolescentes (12-17 anos de idade)
1-2 inalações uma ou duas vezes ao dia. Durante piora da asma, a dose pode ser temporariamente aumentada para um máximo de 4 inalações, duas vezes ao dia.
Crianças (a partir de 4 anos de idade)
1 inalação duas vezes ao dia. Dose máxima diária de 2 inalações.
Symbicort Turbuhaler 12/400 mcg/inalação
Adultos (a partir de 18 anos de idade)
1 inalação uma ou duas vezes ao dia. Em alguns casos, pode ser necessário um máximo de 2 inalações, duas vezes ao dia, como dose de manutenção ou temporariamente durante a piora da asma.
Adolescentes (12-17 anos de idade)
1 inalação uma ou duas vezes ao dia. Durante a piora da asma, a dose de manutenção pode ser temporariamente aumentada para um máximo de 2 inalações, duas vezes ao dia.
Crianças (com idade inferior a 12 anos)
A eficácia e a segurança de Symbicort Turbuhaler 12/400 mcg/inalação em crianças não foi estudada.
Doença Pulmonar Obstrutiva Crônica (DPOC)
Symbicort Turbuhaler 6/200 mcg/inalação
Adultos (a partir de 18 anos de idade):
2 inalações duas vezes ao dia. Dose máxima diária de 4 inalações.
Symbicort Turbuhaler 12/400 mcg/inalação
Adultos (a partir de 18 anos de idade):
1 inalação duas vezes ao dia. Dose máxima diária de 2 inalações.
Informações Gerais
Os pacientes devem ser instruídos a usar Symbicort Turbuhaler mesmo quando estiverem assintomáticos para obter o benefício máximo da terapia.
Não é necessário efetuar qualquer ajuste de dose em paciente idosos.
Não existem dados disponíveis sobre o uso de Symbicort Turbuhaler em pacientes com insuficiência hepática ou renal. Uma vez que a budesonida e o formoterol são essencialmente eliminados por metabolismo hepático, é previsível que se verifique um aumento da exposição em pacientes com cirrose hepática grave.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento.
Não interrompa o tratamento sem o conhecimento do seu médico.
O que devo fazer quando eu me esquecer de usar o Symbicort Turbuhaler?
Se você se esquecer de usar uma dose ocasional de Symbicort Turbuhaler não é necessário compensar a dose esquecida. Apenas use a próxima dose, conforme prescrito pelo seu médico.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Precauções
Não interrompa o tratamento sem o conhecimento de seu médico.
Informe o seu médico, assim que possível, caso sinta que o tratamento não está sendo efetivo ou se os sintomas piorarem.
Mantenha sempre com você seu broncodilatador de ação rápida para uso a qualquer momento, caso esteja utilizando o Symbicort Turbuhaler como terapia com um único inalador.
O tratamento com Symbicort Turbuhaler não deve ser iniciado para tratar exacerbações severas.
O uso prolongado de Symbicort Turbuhaler pode afetar o crescimento de crianças e adolescentes,
portanto, seu uso deverá ser acompanhado de forma rigorosa pelo médico para avaliação dos riscos e benefícios.
Symbicort Turbuhaler deve ser utilizado com cuidado em pacientes que fazem uso de corticosteroides orais ou transferidos do tratamento com corticosteroides orais para o tratamento com inalação.
Informe seu médico se você apresentar outros problemas de saúde, principalmente problemas no coração (incluindo alterações do ritmo cardíaco), diabetes, hipocalemia (concentração inferior ao normal de íons de potássio no sangue) ou tireotoxicose (função alterada da tireoide), se houver necessidade de cirurgias ou se estiver sob situação de estresse.
Symbicort Turbuhaler contém lactose (<1mg/inalação). Esta quantidade geralmente não causa problemas a indivíduos com intolerância à lactose.
Se você estiver utilizando Symbicort Turbuhaler para tratar DPOC, você deve contatar o seu médico se apresentar os seguintes sintomas, que podem ser sinais de pneumonia (infecção do pulmão): febre, calafrios, aumento da produção de muco ou mudança da cor do muco, aumento da tosse ou aumento da dificuldade em respirar.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
Reações Adversas
As reações adversas mais frequentes relacionadas ao medicamento consistem em tremor e palpitação. Estes tendem a ser leves e a desaparecer após alguns dias de tratamento.
As reações adversas que foram associadas à budesonida ou ao formoterol são apresentadas abaixo:
Reação comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento)
Palpitações (percepção incomum dos batimentos cardíacos), candidíase na orofaringe (sapinho), cefaleia (dor de cabeça), tremores, leve irritação na garganta, tosse e rouquidão.
Reação incomum (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento)
Taquicardia (aumento da frequência cardíaca), náusea (enjoo), cãibras musculares, tontura, agitação, ansiedade, nervosismo e perturbações do sono.
Reação rara (ocorre entre 0,01% e 0,1% dos pacientes que utilizam este medicamento)
Arritmias cardíacas (irregularidade do ritmo cardíaco), reações de hipersensibilidade imediatas e tardias, como dermatite (inflamação da pele), exantema (lesões na pele com vermelhidão), urticária (coceira na pele com vermelhidão), prurido (coceira no corpo), angioedema (inchaço da pele, mucosas, vísceras e cérebro) e reação anafilática (reação alérgica intensa), broncoespasmo (contração dos brônquios e bronquíolos, causando o estreitamento dos mesmos) e equimoses (manchas na pele de cor vermelha, vinhosa ou roxa).
Reação muito rara (ocorre em menos de 0,01% dos pacientes que utilizam este medicamento)
Angina pectoris (dor no peito), sinais ou sintomas de efeitos glicocorticosteroides sistêmicos (por exemplo, redução da atividade da glândula supra-renal), hiperglicemia (aumento do nível de açúcar no sangue), depressão e alterações do comportamento.
Informe ao seu médico, cirurgião-dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento.
Informe também à empresa através do seu serviço de atendimento.
População Especial
Dirigir veículos e operar máquinas
Não se espera que Symbicort Turbuhaler interfira na capacidade de dirigir veículos e operar máquinas.
Gravidez e amamentação
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Informe seu médico da ocorrência de gravidez na vigência do tratamento ou após o término. Informar ao médico se está amamentando. Symbicort Turbuhaler só deve ser usado durante a gravidez após análise cuidadosa da situação, sob supervisão médica, principalmente nos primeiros 3 meses de gestação e pouco tempo antes do parto. O uso durante a amamentação deve ser evitado.
Este medicamento pode causar doping.
Composição
Symbicort Turbuhaler 6/100 mcg/inalação
Cada inalação contém 6 mcg de fumarato de formoterol di-hidratado e 100 mcg de budesonida. A dose liberada é de 4,5 mcg de fumarato de formoterol di-hidratado e de 80 mcg de budesonida.
Symbicort Turbuhaler 6/200 mcg/inalação
Cada inalação contém 6 mcg de fumarato de formoterol di-hidratado e 200 mcg de budesonida. A dose liberada é de 4,5 mcg de fumarato de formoterol di-hidratado e de 160 mcg de budesonida.
Symbicort Turbuhaler 12/400 mcg/inalação
Cada inalação contém 12 mcg de fumarato de formoterol di-hidratado e 400 mcg de budesonida. A dose liberada é de 9 mcg de fumarato de formoterol di-hidratado e de 320 mcg de budesonida.
Excipiente: Lactose monoidratada (pode conter resíduo de proteína do leite).
Superdosagem
Se você usar mais inalações do que deveria, contate seu médico para orientações.
Os seguintes efeitos podem ocorrer:
Tremor, cefaleias (dor de cabeça), palpitações (percepção incomum dos batimentos cardíacos) e taquicardia (aumento da frequência cardíaca). Poderá ocorrer também hipotensão (pressão baixa), acidose metabólica (alto nível de ácido no sangue), hipocalemia (concentração inferior ao normal de íons de potássio no sangue) e hiperglicemia (concentração elevada de glicose no sangue circulante). Pode ser indicado o tratamento de suporte e sintomático.
Não é esperado que a superdosagem de Symbicort Turbuhaler cause problemas clínicos. Quando utilizado em longo prazo, em altas doses, podem ocorrer efeitos glicocorticosteroides sistêmicos.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Interação Medicamentosa
Interações resultando em um uso concomitante não recomendado
Interações que afetam o uso de formoterol
Bloqueadores beta-adrenérgicos podem enfraquecer ou antagonizar os efeitos do formoterol. Portanto, o formoterol não deve ser utilizado juntamente com bloqueadores beta-adrenérgicos (incluindo colírios) a menos que existam razões convincentes para seu uso.
Interações a serem consideradas
Interações que afetam o uso de formoterol
O formoterol, como outros beta2-agonistas, deve ser administrado com cautela em pacientes tratados com fármacos como quinidina, disopiramida, procainamida, fenotiazínicos, anti-histamínicos, macrolídeos, inibidores de monoaminoxidase e antidepressivos tricíclicos ou qualquer outro fármaco que prolongue o intervalo QTc, pois a ação dos agonistas adrenérgicos no sistema cardiovascular pode ser potencializada por estes agentes. Os fármacos que são conhecidos por prolongar o intervalo QTc têm um risco aumentado de arritmia ventricular.
A administração concomitante de outros agentes simpatomiméticos pode potencializar os efeitos não desejados de formoterol.
O tratamento concomitante com derivados xantínicos, esteroides ou diuréticos pode potencializar o possível efeito hipopotassêmico dos beta2-agonistas.
Existe um risco elevado de arritmias em pacientes recebendo concomitantemente anestesia com hidrocarbonos halogenados.
Interações que afetam o uso de budesonida
A principal via metabólica da budesonida é via citocromo P450 (CYP) isoenzima 3A4 (CYP3A4). A coadministração de inibidores conhecidos da CYP3A4 (por exemplo, itraconazol, cetoconazol, ritonavir, nelfinavir, amiodarona, claritromicina), pode inibir o metabolismo e aumentar a exposição sistêmica à budesonida. Se estes produtos forem administrados concomitantemente, a função adreno-cortical deve ser monitorada e a dose de budesonida ajustada de acordo com a resposta.
A coadministração de potentes indutores da CYP3A4 (por exemplo, rifampicina) pode aumentar o metabolismo e diminuir a exposição sistêmica à budesonida.
Ação da Substância
Resultados da eficácia
Formoterol
Em humanos, tem-se demonstrado que formoterol é eficaz na prevenção do broncoespasmo induzido por alérgenos inalados, exercícios, ar frio, histamina ou metacolina.
O formoterol administrado pelo inalador Aerolizer em doses de 12 microgramas e 24 microgramas, duas vezes ao dia, exibiu um rápido início da broncodilatação em pacientes com doença pulmonar obstrutiva crônica (DPOC) estável, a qual foi mantida por no mínimo 12 horas e foi acompanhada por uma melhora subjetiva em termos de qualidade de vida, usando-se o “Saint George’s Respiratory Questionnaire”.
Budesonida
Quando utilizado como cápsulas para inalação por pacientes que se beneficiam da terapia com corticoide, pode ocasionar o controle da asma geralmente dentro de 10 dias após o início do tratamento. O uso regular da budesonida reduz a inflamação crônica dos pulmões dos asmáticos. Deste modo, budesonida melhora a função pulmonar e os sintomas da asma, reduz a hiper-reatividade brônquica e previne as exacerbações da asma.
Características Farmacológicas
Grupo farmacoterapêutico
Formoterol
- - Grupo farmacoterapêutico: agonista seletivo beta2-adrenérgico.
- - Código ATC: R03AC13.
Budesonida
- - Grupo farmacoterapêutico: outros medicamentos inalatórios para doenças obstrutivas de vias aéreas, inalantes, glicocorticoides.
- - Código ATC: R03B A02.
Mecanismo de ação e Farmacodinâmica
Formoterol
O formoterol é um potente estimulante seletivo beta2-adrenérgico. Exerce efeito broncodilatador em pacientes com obstrução reversível das vias aéreas. O efeito inicia-se rapidamente (em 1 a 3 minutos), permanecendo ainda significativo 12 horas após a inalação. Com as doses terapêuticas, os efeitos cardiovasculares são pequenos e ocorrem apenas ocasionalmente.
O formoterol inibe a liberação de histamina e dos leucotrienos do pulmão humano sensibilizado passivamente. Algumas propriedades anti-inflamatórias, tais como inibição de edema e do acúmulo de células inflamatórias, têm sido observadas em experimentos com animais.
Estudos in vitro em traqueia de cobaia indicaram que o formoterol racêmico e seus enantiômeros (R, R)- e (S, S)-são adreno-receptores beta2-agonistas altamente seletivos.
O enantiômero (S, S)- foi 800 a 1.000 vezes menos potente que o enantiômero (R, R)- e não afetou a atividade deste no músculo liso da traqueia. Nenhuma base farmacológica para o uso de um dos dois enantiômeros em preferência à mistura racêmica foi demonstrada.
No homem, tem-se demonstrado que formoterol é eficaz na prevenção do broncoespasmo induzido por alérgenos inalados, exercícios, ar frio, histamina ou metacolina.
O formoterol administrado pelo inalador Aerolizer em doses de 12 microgramas e 24 microgramas, duas vezes ao dia, exibiu um rápido início da broncodilatação em pacientes com doença pulmonar obstrutiva crônica (DPOC) estável, a qual foi mantida por no mínimo 12 horas e foi acompanhada por uma melhora subjetiva na Qualidade de Vida, usando-se o “Saint George’s Respiratory Questionnaire”.
Budesonida
A budesonida é um corticosteroide com ação tópica acentuada, mas praticamente desprovida de ação sistêmica no ser humano. Assim como outros glicocorticoides inalatórios, a budesonida exerce seus efeitos farmacológicos através da interação com os receptores de glicocorticoides intracelulares. A produção dos diferentes tipos de citocinas, quimiocinas, enzimas e moléculas de adesão celular, é inibida. Quando utilizado como pó para inalação por pacientes que se beneficiam da terapia com corticosteroide, pode ocasionar o controle da asma geralmente dentro de 10 dias após o início do tratamento. O uso regular da budesonida reduz a inflamação crônica dos pulmões dos asmáticos. Deste modo, budesonida melhora a função pulmonar e os sintomas da asma, reduz a hiper-reatividade brônquica e previne as exacerbações da asma.
Farmacocinética
O formoterol tem uma dose terapêutica na faixa de 12 a 24 microgramas, duas vezes ao dia. Dados de farmacocinética plasmática do formoterol foram coletados em voluntários sadios após inalação de doses mais altas que as recomendadas e em pacientes com DPOC após inalação de doses terapêuticas. A excreção urinária de formoterol inalterado, utilizada como indicador indireto da exposição sistêmica, correlaciona-se com os dados de disposição do fármaco no plasma. A meia-vida de eliminação calculadas para urina e plasma é similar.
Absorção
Formoterol
Após inalação de uma dose única de 120 microgramas de fumarato de formoterol di-hidratado por voluntários sadios, formoterol foi rapidamente absorvido para o plasma, atingindo a concentração máxima de 266 pmol/L em 5 min após a inalação. Em pacientes com DPOC tratados por 12 semanas com 12 ou 24 microgramas de fumarato de formoterol di-hidratado, duas vezes ao dia, a média da concentração plasmática de formoterol estendeu-se entre 11,5 e 25,7 pmol/L e 23,3 e 50,3 pmol/L, respectivamente, 10 min, 2 horas e 6 horas após a inalação.
Estudos investigativos da excreção urinária cumulativa de formoterol e/ou seus enantiômeros (R, R)- e (S, S)- mostrou que a quantidade de formoterol disponível na circulação aumenta em proporção à dose inalada (12 a 96 microgramas). Após inalação de 12 ou 24 microgramas de fumarato de formoterol di-hidratado, duas vezes ao dia durante 12 semanas, a excreção urinária de formoterol inalterado aumentou entre 63 e 73% (última vs. primeira dose), em pacientes com asma, e entre 19 e 38% em pacientes com DPOC. Isto sugere um acúmulo limitado de formoterol no plasma com doses múltiplas. Não houve acúmulo relativo de um enantiômero em relação ao outro após doses repetidas.
Como relatado para outros fármacos inalados, é provável que a maioria do formoterol administrado pelo inalador seja ingerido e, em seguida, absorvido pelo trato gastrintestinal.
Quando 80 microgramas de fumarato de formoterol di-hidratado 3H-marcado foi administrado oralmente a 2 voluntários sadios, pelo menos 65% do fármaco foi absorvido.
Budesonida
A quantidade de budesonida depositada nos pulmões é rápida e completamente absorvida.
O pico de concentração plasmática é atingido imediatamente após a administração. Após correção da dose depositada na orofaringe, a biodisponibilidade absoluta é de 73%.
Apenas 10 a 13% da fração ingerida da dose inalada é biodisponível devido ao metabolismo pré-sistêmico significante no fígado.
Distribuição
Formoterol
A ligação do formoterol às proteínas plasmáticas foi de 61 a 64%, e a ligação à albumina humana sérica foi 34%. Não há saturação dos sítios de ligação na extensão da concentração alcançada com doses terapêuticas.
Budesonida
A ligação de budesonida às proteínas plasmáticas é de 85 a 90% sobre a taxa de concentração de 1 a 100 nmol. A budesonida é extensivamente distribuída nos tecidos. O volume de distribuição de budesonida no estado de equilíbrio é aproximadamente 183 a 301 L. Em experimentos com animais foram observadas altas concentrações no baço e nas glândulas linfáticas, no timo, no córtex da adrenal, nos órgãos reprodutivos e nos brônquios. A budesonida atravessa a barreira placentária em camundongos. A budesonida passa para o leite materno, com a razão de concentração de leite para o plasma de cerca de 0,46. A dose diária estimada para crianças é de 0,3% da dose diária materna e estima-se que a concentração plasmática média em crianças é de 1/600 da concentração observada no plasma materno, mesmo após assumir a biodisponibilidade oral infantil completa.
Biotransformação/Metabolismo
Formoterol
O formoterol é eliminado principalmente pelo metabolismo, sendo a glicuronidação direta a principal via de biotransformação. A O-demetilação seguida de glicuronidação é outra via.
Outras vias de menor importância, envolvem sulfato conjugação do formoterol e deformilação seguida de sulfato conjugação. Isoenzimas múltiplas catalisam a glicuronidação (UGT1A1, 1A3, 1A6, 1A7, 1A8, 1A9, 1A10, 2B7 e 2B15) e O-demetilação (CYP2D6, 2C19, 2C9 e 2A6) do formoterol, sugerindo um baixo potencial para interações fármaco-fármaco, apesar da inibição de uma isoenzima específica envolvida no metabolismo do formoterol. O formoterol não inibe isoenzimas do citocromo P450 em concentrações terapeuticamente relevantes.
Budesonida
A budesonida não é metabolizada nos pulmões. Após a absorção, é metabolizada no fígado, originando vários metabólitos inativos, inclusive 6-beta-hidroxi-budesonida e 16-alfa-hidroxiprednisolona.
A principal via de metabolização da budesonida é a via CYP3A4 e pode ser afetada por inibidores ou indutores conhecidos desta enzima.
Eliminação
Formoterol
Em pacientes asmáticos e com DPOC tratados por 12 semanas com 12 ou 24 microgramas de fumarato de formoterol, duas vezes por dia, aproximadamente 10% e 7% da dose de formoterol inalterado é recuperado na urina, respectivamente. Os enantiômeros (R, R)- e (S, S)- contabilizaram, respectivamente, 40% e 60% da recuperação urinária de formoterol inalterado, após doses únicas (12 a 120 microgramas) em voluntários sadios e após doses únicas e repetidas em pacientes com asma.
O fármaco e seus metabólitos foram completamente eliminados do organismo, sendo aproximadamente dois terços de uma dose oral excretada na urina e um terço nas fezes. O clearance (depuração) renal do formoterol do sangue foi de 150 mL/min.
Em voluntários sadios, a meia-vida de eliminação terminal do formoterol no plasma, após inalação de uma dose única de 120 microgramas de fumarato de formoterol, foi 10 horas e as meias-vidas de eliminação terminal dos enantiômeros (R, R)- e (S, S)-, como derivados das taxas de excreção urinária, foram 13,9 e 12,3 horas, respectivamente.
Budesonida
Em voluntários humanos que inalaram budesonida marcada radioativamente (através de inaladores dosimetrados - MDI), aproximadamente 32% da dose liberada foi recuperada na urina e 15% da dose foi recuperada nas fezes. Após inalação, a budesonida não foi detectada na urina onde foi detectado 16 alfa-hidroxiprednisolona.
A budesonida tem o clearance (depuração) plasmático alto (84 L/h) após dose intravenosa.
A meia-vida de eliminação de budesonida foi aproximadamente 2,8 a 5h.
Populações especiais
Efeitos relacionados ao gênero:
Após correção do peso corpóreo, a farmacocinética de formoterol não diferiu significativamente entre homens e mulheres.
Pacientes geriátricos (65 anos de idade ou mais):
A farmacocinética de formoterol e budesoninda não foi estudada em idosos.
Pacientes pediátricos:
Formoterol
Em um estudo em crianças entre 5 e 12 anos de idade com asma, nas quais se administrou 12 ou 24 microgramas de fumarato de formoterol, duas vezes ao dia por inalação, durante 12 semanas, a excreção urinária de formoterol inalterado aumentou entre 18 e 84%, quando comparado a quantidades medidas após a primeira dose. Acúmulo em crianças não excedeu ao dos adultos, onde o aumento foi entre 63 e 73% (vide acima). Nas crianças estudadas, aproximadamente 6% da dose foi recuperada como formoterol inalterado na urina.
Budesonida
A farmacocinética da budesonida não foi estudada na população pediátrica. No entanto, dados com outros produtos contendo budesonida para inalação sugerem que o peso corporal que normalizou a depuração em crianças acima de 3 anos de idade é aproximadamente 50% maior quando comparado a adultos.
Pacientes com insuficiência hepática/renal:
A farmacocinética de formoterol e budesonida não foi estudada em pacientes com doença hepática ou renal.
Dados de segurança pré-clínicos
Mutagenicidade
Formoterol
Foram conduzidos testes de mutagenicidade cobrindo uma ampla faixa de parâmetros experimentais com formoterol. Não foi encontrado efeito genotóxico em qualquer dos testes efetuados in vitro ou in vivo.
Budesonida
A budesonida não demonstrou ter potencial mutagênico na bateria de testes de mutagenicidade in vitro ou in vivo.
Carcinogenicidade
Formoterol
Estudos de dois anos de formoterol em ratos e camundongos não indicaram qualquer potencial carcinogênico. Camundongos machos tratados com níveis de dosagem bastante altos demonstraram uma incidência ligeiramente maior de tumor benigno de célula subcapsular adrenal. Entretanto, o mesmo não foi observado em um segundo estudo de alimentação para camundongos, no qual alterações patológicas com altas doses consistiram em um aumento da incidência de ambos os tumores benignos de músculo liso no trato genital das fêmeas e tumores de fígado em ambos os sexos. Tumores de músculo liso são efeitos conhecidos de beta-agonistas quando administrados em altas doses em roedores.
Dois estudos em ratos, com diferentes faixas de dosagem, demonstraram um aumento de leiomiomas mesovarianos. Esses neoplasmas benignos são tipicamente associados, em tratamentos prolongados de ratos, com altas dosagens de fármacos beta2-adrenérgicos.
Um aumento na incidência de cistos ovarianos e células tumorais benignas da teca e da granulosa também foi observado; são conhecidos os efeitos dos beta-agonistas em ovário de ratas, sendo os mesmos específicos de roedores. Alguns outros tipos de tumores observados no primeiro estudo com altas dosagens estavam de acordo com a incidência do controle histórico da população e não foram observados no ensaio de doses menores.
Nenhuma das incidências de tumores aumentou a uma extensão estatisticamente significativa na dose mais baixa do segundo estudo com ratos, dose esta que levou a uma exposição sistêmica 10 vezes maior do que a esperada com a dosagem máxima recomendada de formoterol em humanos.
Baseando-se nas conclusões dos estudos e na ausência de potencial mutagênico, conclui-se que o uso de formoterol em doses terapêuticas não apresenta risco carcinogênico.
Budesonida
A budesonida administrada oralmente demonstrou um aumento na incidência de tumor no fígado em ratos machos em doses iniciais de 25 mcg/kg/dia. Estes efeitos também foram observados em um estudo de acompanhamento incluindo outros esteroides (prednisolona e acetonido de triancinolona) e são considerados como efeitos de classe, relacionados com a administração de corticosteroides.
Toxicidade sobre a reprodução
Formoterol
Testes em animais não demonstraram potencial teratogênico do formoterol. Os efeitos do formoterol sobre a fertilidade e desempenho reprodutivo em geral foram avaliados em ratos machos e fêmeas sexualmente maduros. Os estudos de reprodução em ratos não revelou prejuízo na fertilidade ou efeitos sobre o desenvolvimento embrionário inicial em doses orais de até 3 mg/kg (aproximadamente 1200 vezes a dose máxima recomendada pó para inalação diária humana com base em mg/m2). Após administração oral, o formoterol foi excretado no leite de ratas lactantes.
Budesonida
Vide “Advertências e Precauções – Gravidez”.
Cuidados de Armazenamento
Você deve conservar Symbicort Turbuhaler em temperatura ambiente (15°C a 30°C).
Recolocar a tampa após o uso.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características
Symbicort Turbuhaler é um inalador multidose de fluxo dirigido com pó branco seco inalatório.
O inalador é feito de partes plásticas, contendo 60 doses.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Dizeres Legais
Venda sob prescrição médica.
MS - 1.1618.0106
Farm. Resp.:
Dra. Gisele H. V. C. Teixeira - CRF-SP no 19.825
Fabricado por:
AstraZeneca AB (Forskargatan) - Södertälje - Suécia
Importado por:
AstraZeneca do Brasil Ltda.
Rod. Raposo Tavares, km 26,9 - Cotia - SP - CEP 06707-000
CNPJ 60.318.797/0001-00