IMPLANON 68MG NXT CX 1 SER IMPLANTE - ETENOGESTREL - SHRERING PLOUGH na Ative Medicamentos Especiais
Implanon Nxt 1 Imp /1 Aplicação

IMPLANON 68MG NXT CX 1 SER IMPLANTE - ETENOGESTREL - SHRERING PLOUGH na Ative Medicamentos Especiais
Não encontramos este produto para a Ative Medicamentos Especiais no Cliquefarma.
Confira os menores preços para Implanon Nxt 1 Imp /1 Aplicação

Implanon Nxt 1 Imp /1 Aplicação
30.15%
R$ 850,12
Onco Express Medicamentos Especiais e Oncológicos
29.59%
R$ 857,00
OncoExpresso Medicamentos
29.42%
R$ 859,00
Farma Visa
24.68%
R$ 916,70
Life Medicamentos
24.68%
R$ 916,70
Para que serve
Leia cuidadosamente esta bula antes de decidir se você deseja que Implanon NXT seja inserido em seu corpo:
- Esta bula fornece informações que podem auxiliá-la na decisão de começar a usar Implanon NXT. Ela também a orientará sobre como usar Implanon NXT de modo apropriado e seguro.
- Guarde esta bula. Você poderá precisar lê-la novamente enquanto estiver usando Implanon NXT, uma vez que é importante estar ciente sobre assuntos que não afetam você agora, mas que podem afetá-la no futuro.
- Este medicamento foi prescrito para você. Não o indique para outras pessoas. Isso pode prejudicá-las, mesmo que os sintomas que elas apresentem sejam parecidos com os seus.
- Se você tiver alguma dúvida, peça auxílio ao seu médico ou farmacêutico.
- Se algum efeito adverso se agravar ou se você perceber qualquer efeito adverso não mencionado nesta bula, informe o seu médico ou farmacêutico.
Implanon NXT é indicado para evitar a gravidez.
Como Implanon NXT funciona?
Implanon NXT é um implante anticoncepcional disponibilizado em um aplicador descartável. O implante é um pequeno bastão de plástico, macio, flexível, com 4 cm de comprimento e 2 mm de diâmetro que contém 68 mg da substância ativa etonogestrel.
O aplicador permite que o médico insira o implante diretamente sob a pele de seu braço. O etonogestrel é um hormônio feminino sintético, semelhante à progesterona. Uma pequena quantidade de etonogestrel é liberada continuamente na corrente sanguínea.
O bastão é feito de copolímero de etileno vinil acetato, um plástico que não dissolve no corpo. Ele também contém uma pequena quantidade de sulfato de bário (que o torna visível no raio-X) e de estearato de magnésio.
O implante é inserido logo abaixo da pele. O componente ativo, etonogestrel, funciona de duas maneiras:
- Impede que o óvulo seja liberado do ovário.
- Altera a secreção do colo do útero, dificultando a entrada de espermatozoides no útero.
Como resultado, Implanon NXT protege você da gravidez por um período de até três anos. Entretanto, se você estiver acima do peso, o médico irá orientá-la a substituir o implante em um prazo menor. Implanon NXT é um dos vários métodos de prevenção da gravidez.
Outro método anticoncepcional frequentemente utilizado é a pílula combinada.
Ao contrário das pílulas combinadas, Implanon NXT pode ser usado por mulheres que não podem ou não querem usar estrogênios.
Quando você usa Implanon NXT, não precisa lembrar-se de administrar o anticoncepcional diariamente. Essa é uma das razões de Implanon NXT ser um anticoncepcional muito confiável (com eficácia superior a 99%). Nas raras situações em que o implante não for inserido corretamente ou não chegar a ser totalmente inserido, você poderá não estar protegida contra a gravidez.
Quando você está usando Implanon NXT, a sua menstruação pode sofrer alterações e tornar-se ausente, irregular, não frequente, frequente, prolongada ou raramente intensa.
O padrão de sangramento durante os três primeiros meses de uso do produto geralmente indica o seu futuro padrão de sangramento. As cólicas menstruais podem melhorar.
Implanon NXT pode ser retirado a qualquer momento.
Contraindicação
Não use Implanon NXT se apresentar quaisquer das condições listadas a seguir.
Se alguma delas se aplicar ao seu caso, converse com o seu médico antes de Implanon NXT ser inserido.
O seu médico poderá lhe aconselhar a utilizar um método não hormonal para evitar a gravidez.
Este medicamento é contraindicado para uso por mulheres que:
- Tenham alergia a etonogestrel ou a qualquer componente de Implanon NXT;
- Tenham trombose. Trombose é a formação de coágulo em um vaso sanguíneo (por exemplo, das pernas [trombose venosa profunda] ou dos pulmões [embolia pulmonar]);
- Tenham ou já tenham tido icterícia (coloração amarelada da pele), doença grave do fígado (quando o fígado não funciona adequadamente) ou tumor no fígado;
- Tenham (já tenham tido) ou possam ter câncer de mama ou de órgãos genitais;
- Tenham algum sangramento vaginal de origem desconhecida.
Caso ocorram quaisquer dessas situações pela primeira vez durante o uso de Implanon NXT, contate o seu médico imediatamente.
Este medicamento é contraindicado para uso por mulheres grávidas ou que suspeitam que possam estar grávidas.
Em caso de dúvida, você deve fazer um teste de gravidez antes de Implanon NXT ser inserido.
Como usar
Antes de Implanon NXT ser inserido, informe o seu médico se você está grávida ou suspeita que possa estar grávida (por exemplo, se você teve relações sexuais sem proteção durante o ciclo menstrual atual).
Tanto a inserção como a retirada de Implanon NXT devem ser feitas somente por um médico que esteja familiarizado com as técnicas de inserção e retirada descritas na bula para o profissional da saúde deste medicamento.
O médico decidirá com você qual é o momento mais apropriado para a inserção do implante. Isso dependerá de sua própria condição (por exemplo, o método anticoncepcional que estiver utilizando). A menos que você esteja substituindo outro método anticoncepcional hormonal, a inserção deve ser realizada entre o 1º e o 5º dia de seu ciclo menstrual espontâneo para descartar a possibilidade de gravidez. O seu médico irá orientá-la.
Antes de Implanon NXT ser inserido ou retirado, o seu médico lhe aplicará um anestésico local. Implanon NXT é inserido diretamente sob a pele da parte interna superior do braço não dominante (o braço que você não usa para escrever).
Implanon NXT deve ser retirado ou substituído não mais do que três anos após a sua inserção.
Para ajudá-la a lembrar-se quando e onde Implanon NXT foi inserido e qual a data máxima para a sua retirada, o seu médico lhe entregará um cartão da usuária contendo essas informações.
Guarde o cartão em um local seguro!
Ao final do procedimento de inserção, o seu médico irá pedir-lhe para tentar verificar a presença de Implanon NXT por meio de palpação (sentindo o implante abaixo da pele).
Um implante corretamente inserido deve ser facilmente palpável tanto pelo médico como por você, e você deve ser capaz de sentir ambas as extremidades dele entre o polegar e o dedo indicador.
Deve-se compreender que a palpação não é 100% adequada para verificar a presença de Implanon NXT.
Caso o implante não possa ser palpado imediatamente após a inserção ou a qualquer momento, pode ser que ele não tenha sido inserido ou que tenha sido inserido profundamente.
Em caso de dúvida, você deverá usar um método anticoncepcional de barreira (por exemplo, camisinha) até que você e o seu médico estejam absolutamente seguros de que o implante foi inserido.
O médico poderá precisar do auxílio de um exame de raio-X, tomografia computadorizada, ultrassom ou ressonância magnética ou colher amostra de sangue para ter certeza de que o implante está no seu braço.
Apenas quando o implante que não era palpável for localizado pelo seu médico, sua remoção poderá ser indicada.
Se o implante não for localizado no braço após uma procura minuciosa, o seu médico poderá usar raio-X ou outros métodos de imagem no seu tórax.
Caso você deseje substituir Implanon NXT, um novo implante pode ser inserido pelo seu médico imediatamente após a retirada do anterior.
O novo implante pode ser inserido no mesmo braço, geralmente no mesmo local do anterior. O seu médico irá aconselhá-la.
Informações adicionais sobre Implanon NXT:
Implanon NXT deve ser inserido e removido apenas por um médico familiarizado com esses procedimentos. Para assegurar uma retirada sem complicações, é necessário que Implanon NXT seja inserido logo abaixo da pele.
O anestésico local deve ser aplicado antes de inserir ou retirar Implanon NXT. O risco de complicações é pequeno desde que as instruções sejam seguidas.
Como Implanon NXT deve ser inserido?
- A inserção de Implanon NXT deve ser feita apenas por um médico familiarizado com o procedimento.
- Para facilitar a inserção de Implanon NXT, você deve deitar-se de costas, com o cotovelo levemente dobrado e o braço virado para fora.

- Implanon NXT será inserido na parte interna superior do braço não dominante (aquele que você não usa para escrever).
- O local da inserção será indicado na pele, e será desinfetado e anestesiado.
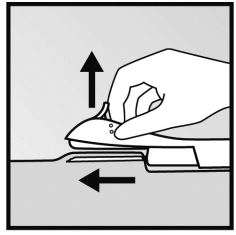
- A pele será esticada e a agulha inserida diretamente sob a pele. Quando a ponta da agulha estiver dentro da pele, a agulha será inserida completamente com um movimento paralelo à superfície da pele.

- O deslizante roxo é destravado ao ser empurrado levemente para baixo e movido totalmente para trás, até que ele fique preso na parte posterior do aplicador, de forma que a agulha fique retraída. O implante permanecerá no braço quando a agulha for retirada.
- A presença do implante deve ser verificada por palpação imediatamente após a inserção. Um implante corretamente inserido pode ser sentido entre os dedos polegar e indicador pelo médico, bem como por você. Deve-se compreender que a palpação não é 100% adequada para verificar a presença de Implanon NXT.
- Se o implante não puder ser palpado ou quando sua presença for duvidosa, outros métodos devem ser usados para confirmar a sua presença.
- Apenas quando o implante que não era palpável for localizado pelo seu médico, sua remoção poderá ser indicada.
- Até que a presença do implante seja confirmada, você pode não estar protegida contra a gravidez, e um método anticoncepcional de barreira (por exemplo, camisinha) deve ser usado.
- Será feito um curativo compressivo com uma gaze estéril para minimizar o risco de formação de hematoma. Você deve retirar o curativo compressivo em 24 horas e o pequeno curativo sobre o local da incisão em 3 a 5 dias.
- Após a inserção do implante, o médico irá entregar-lhe um CARTÃO DA USUÁRIA no qual constará o local de inserção, a data de inserção e a data máxima para que o implante seja retirado ou substituído. Guarde-o em um local seguro, uma vez que as informações no cartão podem facilitar a retirada do implante posteriormente.
Como Implanon NXT deve ser retirado?
- A retirada de Implanon NXT deve ser feita apenas por médico familiarizado com o procedimento.
- Implanon NXT é retirado a seu pedido ou, o mais tardar, três anos após a sua inserção.
- O local de inserção do implante é indicado no cartão da usuária.
- O médico localizará o implante. Caso o implante não possa ser localizado por palpação, o médico pode recorrer às técnicas de raio-X, tomografia computadorizada, ultrassonografia ou ressonância magnética.
- O seu braço será desinfetado e anestesiado.
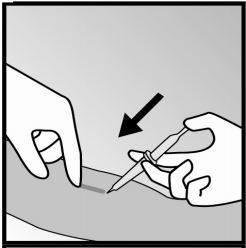
- Será feito um pequeno corte, logo abaixo da ponta do implante.
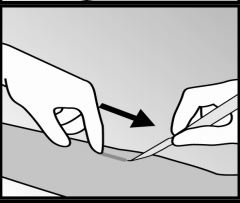
- O implante será puxado delicadamente no sentido da incisão e retirado com uma pinça.
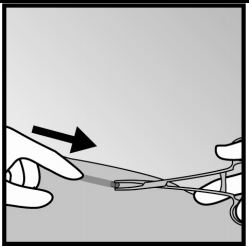
- Ocasionalmente, o implante pode estar rodeado por um tecido duro. Nesse caso, será necessário um corte pequeno no tecido antes que o implante possa ser retirado.
- Se você quiser que o seu médico substitua Implanon NXT por outro implante, um novo implante pode ser inserido usando a mesma incisão.
- O corte será fechado com um curativo.
- Será colocada uma gaze estéril compressiva para minimizar o risco de formação de equimose (mancha na pele produzida pelo extravasamento de sangue). Você deve retirar o curativo compressivo em 24 horas e o pequeno curativo sobre o local da incisão em 3 a 5 dias.
Interrupção do tratamento:
Você pode pedir para o seu médico retirar o implante a qualquer momento que desejar. Se o implante não puder ser localizado por palpação, o médico poderá usar raio-X, tomografia computadorizada, ultrassom ou ressonância magnética para localizá-lo. Dependendo da exata posição do implante, a retirada pode ser difícil e pode requerer uma cirurgia.
Caso não deseje ficar grávida após a retirada de Implanon NXT, converse com o seu médico sobre outros métodos anticoncepcionais.
Se você parar de usar Implanon NXT porque quer engravidar, geralmente recomenda-se esperar até a próxima menstruação natural para engravidar. Isso ajudará a calcular a data provável de nascimento do bebê.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Não interrompa o tratamento sem o conhecimento do seu médico.
O que devo fazer quando eu me esquecer de usar Implanon NXT?
Considerando as características de Implanon NXT, não há a possibilidade de você esquecer uma dose.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Precauções
Implanon NXT, assim como todos os anticoncepcionais hormonais, não protege contra infecções por HIV (AIDS) ou contra qualquer doença sexualmente transmissível.
Antes de começar a usar Implanon NXT:
Se Implanon NXT for utilizado na presença de quaisquer das condições descritas a seguir, o seu médico deverá observá-la cuidadosamente.
O seu médico pode explicar-lhe o que fazer. Assim, se quaisquer dessas condições se aplicam a você, informe o seu médico antes de Implanon NXT ser inserido.
Além disso, se quaisquer dessas condições desenvolverem-se ou piorarem enquanto você estiver usando Implanon NXT, você deverá informar o seu médico se:
- Já teve câncer de mama;
- Tem câncer no fígado, uma vez que um possível efeito de Cerazette não pode ser excluído;
- Já teve formação de coágulo em um vaso sanguíneo (trombose);
- Tem diabetes;
- Tem epilepsia;
- Tem tuberculose;
- Tem pressão sanguínea alta;
- Tem ou teve cloasma (manchas marrom-amareladas na pele, particularmente no rosto); neste caso, evite muita exposição ao sol ou raios ultravioleta.
Câncer:
A informação apresentada a seguir foi obtida em estudos com mulheres que tomaram diariamente um anticoncepcional combinado oral contendo dois diferentes hormônios femininos (“a pílula”). Não se sabe se essas observações são aplicáveis a mulheres que usam um anticoncepcional hormonal diferente, como implantes contendo apenas progestagênios.
O câncer de mama tem sido diagnosticado um pouco mais frequentemente em mulheres que tomaram anticoncepcionais combinados orais (pílulas), mas não se sabe se ele é causado pelo tratamento. Por exemplo, pode ser que tumores sejam mais diagnosticados em mulheres que usam pílulas combinadas porque elas são examinadas com mais frequência pelo médico.
O aumento da ocorrência de câncer de mama torna-se gradualmente menor após a interrupção do uso da pílula combinada. É importante checar as suas mamas regularmente e você deve contatar o seu médico se sentir algum caroço em suas mamas.
Você deve também informar o seu médico se uma parente próxima tem ou teve câncer de mama. Em casos raros, tumores hepáticos benignos e, ainda mais raramente, malignos têm sido relatados por mulheres usando pílulas. Se você tiver dor abdominal grave, deve contatar o seu médico imediatamente.?
Trombose:
Um coágulo sanguíneo na veia (conhecido como “trombose venosa”) pode bloquear uma veia. Isso pode ocorrer nas veias da perna (trombose venosa profunda, TVP), dos pulmões (embolia pulmonar) ou de outros órgãos. Um coágulo sanguíneo na artéria (conhecido como “trombose arterial”) pode bloquear a artéria. Por exemplo, um coágulo sanguíneo em uma artéria do coração pode causar ataque cardíaco e em uma artéria do cérebro pode causar acidente vascular cerebral.
O risco de a mulher em uso de qualquer anticoncepcional hormonal combinado desenvolver tais coágulos, comparado ao risco da que não faz uso desse tipo de método, é aumentado. O risco não é tão alto como o de desenvolver coágulo sanguíneo durante a gravidez.
Acredita-se que o risco em usuárias de um método de progestagênio isolado como Implanon NXT seja menor que o risco em usuárias de pílulas que também contêm estrogênios. Houve relatos de formação de coágulos sanguíneos, como embolia pulmonar, trombose venosa profunda, ataques cardíacos e derrames em mulheres que utilizam implantes de etonogestrel.
Se você notar subitamente possíveis sinais de trombose, você deve consultar o seu médico imediatamente.
Alteração do padrão de sangramento vaginal:
Assim como com outros anticoncepcionais à base de progestagênio isolado, o seu padrão de sangramento menstrual pode alterar-se quando você estiver usando Implanon NXT. Você pode ter uma alteração na frequência (ausente, menos frequente, mais frequente ou contínua), na intensidade (reduzida ou aumentada) ou na duração do sangramento.
A ausência de sangramento foi relatada por aproximadamente 1 em cada 5 mulheres, enquanto 1 em cada 5 mulheres relatou sangramento frequente e/ou prolongado.
Ocasionalmente, sangramento intenso foi observado. Em estudos clínicos, alterações no sangramento foram os motivos mais comuns para interromper o tratamento com Implanon NXT (aproximadamente 11% dos casos).
O padrão de sangramento durante os três primeiros meses geralmente indica o futuro padrão de sangramento.
A alteração no padrão de sangramento não significa que Implanon NXT não é adequado para você ou que não está fornecendo proteção anticoncepcional.
Em geral, nenhuma providência precisa ser tomada. Todavia, se o sangramento menstrual for intenso ou prolongado, você deverá consultar o seu médico.
Eventos relacionados à inserção ou à retirada:
O implante pode migrar do local de inserção original no braço, se inserido incorretamente ou devido a forças externas (por exemplo, manipulação do implante ou esporte de contato). Nesses casos, a localização do implante pode ser mais difícil e a sua retirada pode requerer uma incisão maior ou remoção cirúrgica em um hospital.
Caso o implante não possa ser encontrado, e não haja evidência de que ele tenha sido expulso, a anticoncepção e o risco de efeitos indesejáveis relacionados ao progestagênio poderão durar mais tempo do que você deseja.
Em casos raros, há relatos de implantes localizados na artéria pulmonar (um vaso sanguíneo do pulmão).
Se o implante não for localizado no braço, o seu médico pode utilizar raio-X ou outros métodos de imagem no tórax. Se o implante for localizado no tórax, poderá ser necessária uma cirurgia para a remoção.
Cistos ovarianos:
Durante o uso de anticoncepcionais hormonais de baixa dose, pequenas bolsas contendo líquido podem desenvolver-se nos ovários. Elas são chamadas de cistos ovarianos. Geralmente, os cistos desaparecem espontaneamente.
Algumas vezes, eles causam dores abdominais leves. Apenas raramente podem causar problemas mais graves.
Implante quebrado ou encurvado:
Se o implante quebrar ou encurvar enquanto estiver inserido no seu braço, o seu funcionamento não será afetado. Em caso de dúvidas, contate o seu médico.
Quando você deve consultar o seu médico?
Exames médicos periódicos:
Antes de Implanon NXT ser inserido, o seu médico deverá perguntar sobre a sua história de saúde e a de seus parentes próximos.
O médico também irá aferir sua pressão sanguínea e, dependendo da sua condição, poderá também solicitar outros exames.
Quando você estiver usando Implanon NXT, o seu médico solicitará o seu retorno para uma avaliação médica algum tempo após a inserção de Implanon NXT. A frequência e o tipo de avaliação médica dependerão de sua condição clínica.
Consulte o seu médico imediatamente se:
Notar qualquer alteração na sua saúde, especialmente envolvendo qualquer um dos itens mencionados nesta bula.
- Notar possíveis sinais de trombose (p. ex., dor intensa ou inchaço nas pernas, dores inexplicáveis no peito, dificuldade para respirar, tosse anormal, especialmente se expelir sangue);
- Tiver dor intensa e repentina de estômago ou ficar com aspecto de que está com icterícia (coloração amarelada da pele);
- Sentir nódulos nas mamas;
- Sentir dor intensa e repentina na porção inferior do abdome ou na área do estômago;
- Tiver sangramento vaginal abundante e anormal;
- Precisar ser imobilizada (p. ex., se tiver que ficar de repouso absoluto na cama) ou se estiver em vias de ser submetida a cirurgia (consulte o seu médico com pelo menos quatro semanas de antecedência);
- Suspeitar que está grávida.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
Reações Adversas
Como todos os medicamentos, Implanon NXT pode causar efeitos colaterais, embora nem todas as pacientes os apresentem.
Sangramento vaginal pode ocorrer em intervalos irregulares durante o uso de Implanon NXT. Isso pode ser apenas uma ligeira mancha que pode não requerer uso de absorvente ou um sangramento mais intenso como se fosse uma menstruação escassa, e requer uso de absorvente.
Você também pode não apresentar sangramento. Os sangramentos irregulares não são sinais de redução da proteção anticoncepcional de Implanon NXT. Em geral, nenhuma providência precisa ser tomada. Se, entretanto, o sangramento menstrual for intenso ou prolongado, consulte o seu médico.
Possíveis efeitos colaterais graves:
Reações adversas graves são descritas em Precauções do Implanon NXT.
As reações a seguir foram relatadas:
Reações muito comuns (ocorreram em mais de 10% das pacientes que utilizaram este medicamento):
Espinhas (acne), dor de cabeça, aumento de peso corporal, sensibilidade e dor nas mamas, infecções vaginais, menstruação irregular.
Reações comuns (ocorreram entre ? 1% e < 10% das pacientes que utilizaram este medicamento):
Queda de cabelo, tontura, depressão, instabilidade emocional, nervosismo, diminuição do desejo sexual, aumento do apetite, dor abdominal, náusea, gases no estômago e intestino, cólicas menstruais, diminuição de peso corporal, sintomas de gripe, dor, fadiga, ondas de calor, dor no local do implante, reação no local do implante, cistos ovarianos.
Reações incomuns (ocorreram entre ? 0,1% e < 1% das pacientes que utilizaram este medicamento):
Coceira, coceira na área genital, vermelhidão na pele, crescimento excessivo de pelos, enxaqueca, ansiedade, insônia, sonolência, diarreia, vômitos, constipação, dificuldade ou dor para urinar, infecção do trato urinário, desconforto vaginal (por exemplo, secreção vaginal), aumento das mamas, secreção nas mamas, dor nas costas, febre, retenção de líquidos, reações alérgicas, inflamação e dor de garganta, rinite, dores articulares, dores musculares, dores ósseas.
Além dessas reações, ocasionalmente observou-se elevação da pressão arterial. Também observou-se pele oleosa. Você deve procurar atendimento médico imediatamente se tiver sintomas de reação alérgica grave, tais como: (i) inchaço na face, língua ou faringe, (ii) dificuldade de engolir, ou (iii) urticária e dificuldade para respirar.
Durante a inserção ou retirada de Implanon NXT, pode ocorrer hematoma, dor, inchaço ou coceira e, em raros casos, infecção. Uma cicatriz pode se formar ou um abscesso pode se desenvolver no local do implante.
Pode ocorrer sensação de dormência ou falta de sensibilidade. A expulsão ou a migração de Implanon NXT é possível, especialmente se o implante não for inserido adequadamente. Pode ser necessária uma intervenção cirúrgica para a sua retirada. Raramente, foram relatados casos em que implantes foram localizados em um vaso sanguíneo, inclusive em um vaso sanguíneo dos pulmões
Se algum efeito adverso se agravar, ou se você perceber qualquer efeito adverso não mencionado nesta bula, informe o seu médico.
Informe ao seu médico, cirurgião-dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento. Informe também à empresa através do seu serviço de atendimento.
População Especial
Lactação:
Implanon NXT pode ser usado por mulheres que estão amamentando. Embora uma pequena quantidade da substância ativa de Implanon NXT passe para o leite materno, não há influência na produção nem na qualidade do leite materno, tampouco no crescimento e desenvolvimento da criança.
Se você estiver amamentando e quiser usar Implanon NXT, converse com o seu médico.
Pacientes idosas:
Implanon NXT é um medicamento de uso exclusivo em pacientes em idade reprodutiva. Não se destina a uso em pacientes com idade ? 60 anos.
Efeitos sobre a habilidade de dirigir e operar máquinas:
Não há indícios de qualquer efeito do uso de Implanon NXT sobre o estado de alerta e concentração.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
Composição
Cada implante contém:
Etonogestrel 68mg.
Excipientes: copolímero de etileno vinil acetato, sulfato de bário e estearato de magnésio.
A taxa de liberação é de aproximadamente 60-70 mcg/dia na 5ª-6ª semana e reduz a aproximadamente 35-45 mcg/dia no final do primeiro ano, 30-40 mcg/dia no final do segundo ano e 25-30 mcg/dia no final do terceiro ano.
O aplicador inovador foi projetado para ser manuseado com uma mão e para facilitar a inserção subdérmica correta do implante.
Superdosagem
Considerando as características de Implanon NXT, não há a possibilidade de você receber doses excessivas de etonogestrel. É improvável que você ou alguém receba mais de um implante.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Interação Medicamentosa
Nota: As bulas dos medicamentos de uso concomitante devem ser consultadas para identificação de interações potenciais.
Influência de outros medicamentos sobre Etonogestrel (substância ativa)
Interações entre anticoncepcionais hormonais e outros medicamentos podem levar ao sangramento inesperado e/ou à falha na anticoncepção. As interações a seguir foram relatadas na literatura (principalmente com anticoncepcionais combinados, mas, ocasionalmente, também com anticoncepcionais com progestagênios isolados).
Metabolismo hepático
Podem ocorrer interações com medicamentos ou produtos fitoterápicos indutores de enzimas microssomais, especificamente enzimas do citocromo P450 (CYP), que podem resultar em aumento da depuração, reduzindo a concentração plasmática de hormônios sexuais e podem diminuir a eficácia de Etonogestrel (substância ativa). Esses produtos incluem fenitoína, barbitúricos, primidona, bosentana, carbamazepina, rifampicina e, possivelmente também, oxcarbazepina, topiramato, felbamato, griseofulvina, alguns inibidores não-nucleosídeo da protease do HIV (por exemplo, ritonavir) e inibidores da transcriptase reversa (por exemplo, efavirenz), e produtos fitoterápicos contendo Hypericum Perforatum, erva de São João ou St. John's wort.
A indução enzimática pode ocorrer após alguns dias de tratamento. A indução enzimática máxima é geralmente observada em algumas semanas. Após descontinuação da terapia, a indução enzimática pode durar por até 28 dias.
Quando co-administradas com Etonogestrel (substância ativa), muitas combinações de inibidores de protease do HIV (por exemplo, nelfinavir) e inibidores não-nucleosídeos da transcriptase reversa (por exemplo, nevirapina), e/ou combinações com medicamentos utilizados no tratamento de hepatite C (por exemplo, boceprevir, telaprevir), podem aumentar ou diminuir as concentrações plasmáticas dos progestagênios, incluindo o Etonogestrel (substância ativa). O efeito líquido dessas alterações pode ser clinicamente relevante em alguns casos.
Mulheres que estejam recebendo quaisquer desses medicamentos indutores de enzimas hepáticas ou produtos fitoterápicos listados anteriormente devem ser informadas de que a eficácia de Etonogestrel (substância ativa) pode estar reduzida. Se for decidido continuar com o uso de Etonogestrel (substância ativa), as mulheres devem ser orientadas a utilizar, adicionalmente, um método anticoncepcional não-hormonal durante o tempo de administração concomitante da droga e por 28 dias após a descontinuação.
A administração concomitante de inibidores fortes (por exemplo, cetoconazol, itraconazol, claritromicina) ou moderados (por exemplo, fluconazol, diltiazem, eritromicina) da CYP3A4 podem aumentar as concentrações séricas dos progestagênios, incluindo o Etonogestrel (substância ativa).
Influência de Etonogestrel (substância ativa) sobre outros medicamentos
Os anticoncepcionais hormonais podem interferir com o metabolismo de outros fármacos e, consequentemente, as concentrações plasmáticas e tissulares podem ser aumentadas (por exemplo, ciclosporina) ou diminuídas (por exemplo, lamotrigina).
Testes laboratoriais
Dados obtidos com anticoncepcionais combinados orais mostraram que os esteroides anticoncepcionais podem influenciar os resultados de certos testes de laboratório, incluindo parâmetros bioquímicos do fígado, da tireoide, da adrenal e de função renal, das concentrações séricas de proteínas (transportadoras), por exemplo, globulina transportadora de corticosteroides, frações lípide/lipoproteína, parâmetros do metabolismo de carboidrato e da coagulação e fibrinólise.
As alterações geralmente permanecem dentro da variação normal. Não se sabe em que extensão isso também se aplica aos anticoncepcionais de progestagênio isolado.
Ação da Substância
Resultados de eficácia
O efeito contraceptivo de Etonogestrel (substância ativa) é obtido principalmente por inibição da ovulação. Não foram observadas ovulações nos primeiros 2 anos de uso e só raramente no terceiro ano. Além da inibição da ovulação, Etonogestrel (substância ativa) também causa alterações no muco cervical, que impedem a passagem de espermatozoides. Os estudos clínicos foram conduzidos em mulheres com idades entre 18 e 40 anos. Embora não tenha sido feita nenhuma comparação direta, a eficácia contraceptiva pareceu ser, pelo menos, comparável àquela dos anticoncepcionais orais combinados.
O alto grau de proteção contra a gravidez é obtido porque, entre outras razões, em comparação aos anticoncepcionais orais, a ação contraceptiva de Etonogestrel (substância ativa) não depende da ingestão regular de comprimidos. A ação contraceptiva de Etonogestrel (substância ativa) é reversível, o que é perceptível pelo rápido retorno ao ciclo menstrual normal após a retirada do implante. Embora Etonogestrel (substância ativa) iniba a ovulação, a atividade ovariana não é totalmente suprimida.2 A concentração média de estradiol permanece acima do nível observado na fase pré-folicular.
Características farmacológicas
Propriedades farmacodinâmicas
Grupo farmacoterapêutico: progestagênios.
Classificação ATC: G03ACO8.
Etonogestrel (substância ativa) é um implante subdérmico, não biodegradável, contendo Etonogestrel (substância ativa), que é o metabólito biologicamente ativo do desogestrel, um progestagênio amplamente utilizado em anticoncepcionais orais. É estruturalmente derivado da 19-nortestosterona e liga-se com alta afinidade aos receptores de progesterona nos órgãos-alvo.
Em um estudo de 2 anos, no qual a densidade mineral óssea de 44 usuárias de Etonogestrel (substância ativa) foi comparada com a do grupo-controle de 29 usuárias de DIU, não foram observados efeitos adversos sobre a massa óssea. Durante o uso de Etonogestrel (substância ativa), não foram observados efeitos clinicamente relevantes sobre o metabolismo lipídico. O uso de anticoncepcionais contendo progestagênios pode ter um efeito sobre a resistência à insulina e a tolerância à glicose. Estudos clínicos também mostraram que as usuárias de Etonogestrel (substância ativa) frequentemente têm sangramento menstrual menos doloroso (dismenorreia).
Propriedades farmacocinéticas
Absorção
Após a inserção de Etonogestrel (substância ativa), o Etonogestrel (substância ativa) é rapidamente absorvido, passando para a circulação. As concentrações que inibem a ovulação são atingidas em 1 dia. As concentrações séricas máximas (entre 472 e 1270 pg/mL) são atingidas entre 1 a 13 dias. O índice de liberação do implante diminui com o tempo. Como resultado, as concentrações séricas diminuem rapidamente durante os primeiros meses.
No fim do primeiro ano, a concentração média é de cerca de 200 pg/mL (variação de 150 a 261 pg/mL), diminuindo lentamente para 156 pg/mL (variação de 111 a 202 pg/mL) no final do terceiro ano. As variações observadas nas concentrações séricas podem ser parcialmente atribuídas a diferenças no peso corporal.
Distribuição
95,5 a 99% do Etonogestrel (substância ativa) ligam-se a proteínas séricas, predominantemente à albumina e, em menor extensão, à globulina transportadora de hormônios sexuais. Os volumes de distribuição central e total são de 27 e 220 litros, respectivamente, e dificilmente são alterados durante o uso de Etonogestrel (substância ativa).
Metabolismo
O Etonogestrel (substância ativa) sofre hidroxilação e redução. Os metabólitos são conjugados em sulfatos e glicuronídeos. Estudos em animais mostram que a circulação entero-hepática provavelmente não contribui para a atividade progestagênica do Etonogestrel (substância ativa).
Eliminação
Após a administração intravenosa de Etonogestrel (substância ativa), a meia-vida média de eliminação é de cerca de 25 horas e a depuração sérica é de aproximadamente 7,5 L/h. A depuração e a meia-vida de eliminação permanecem constantes durante o período de tratamento. O Etonogestrel (substância ativa) e seus metabólitos são excretados como esteroides livres ou conjugados através da urina e fezes (1,5:1).
Após a inserção de Etonogestrel (substância ativa) em mulheres lactantes, o Etonogestrel (substância ativa) é excretado no leite na razão leite/soro de 0,44-0,50 durante os primeiros quatro meses. Em mulheres lactantes que utilizam Etonogestrel (substância ativa) a média de transferência de Etonogestrel (substância ativa) para o lactente é de, aproximadamente, 0,2% da dose materna diária de Etonogestrel (substância ativa) (2,2% quando os valores são normalizados por quilo de peso). As concentrações apresentam declínio gradual e estatisticamente significativo ao longo do tempo.
Dados de segurança pré-clínicos
Estudos toxicológicos não revelaram quaisquer efeitos, a não ser aqueles que podem ser explicados com base nas propriedades hormonais do Etonogestrel (substância ativa), independentemente da via de administração.
Cuidados de Armazenamento
Conservar em temperatura ambiente (entre 15 e 30°C). Proteger da luz e umidade.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Todo medicamento deve ser mantido fora do alcance das crianças.
Após aberto, Implanon NXT deve ser inserido imediatamente.?
Características organolépticas
Implanon NXT é um pequeno bastão macio e flexível, radiopaco, não biodegradável, branco a levemente amarelo ou levemente marrom, mede 4 cm de comprimento e 2 mm de diâmetro, e está presente em um aplicador estéril, descartável e pronto para uso.
Antes de usar, observe o aspecto do medicamento.
Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Dizeres Legais
MS 1.0171.0088
Farm. Resp.:
Cristina Matushima
CRF-SP nº 35.496.
Registrado e importado por:
Schering-Plough Indústria Farmacêutica Ltda.
Rua João Alfredo, 353
São Paulo/SP
CNPJ 03.560.974/0001-18
Indústria Brasileira.
Fabricado por:
N.V. Organon, Oss, Holanda.
Venda sob prescrição médica.